
本文由藥明(míng)康德內(nèi)容團隊編輯
甲基在生物(wù)活性分子中普遍存在,根據美國(guó)亞利桑那(nà)大學Jόn Njarðarson教授團隊統計的“2018年(nián)全球前200位的藥品”,一(yī)半以上(shàng)的藥物(wù)分子至少(shǎo)包含一(yī)個甲基基團。甲基化反應在糖、多肽、核酸、生物(wù)堿以及藥物(wù)分子的結構修飾中得到廣泛的研究。在設計候選藥物(wù)時(shí),甲基化修飾通(tōng)常用來改善藥物(wù)分子的生物(wù)活性及物(wù)理特性。除此之外(wài),甲基化過程還能(néng)改變候選藥物(wù)分子的溶解度、提高藥物(wù)分子的脫靶選擇性,甚至還可(kě)以将激動劑轉變為(wèi)拮抗劑等。而在生命科學領域,DNA、RNA的甲基化修飾在基因編輯及調控、疾病診斷等方面發揮重要(yào)的作(zuò)用。
以下(xià)列舉了(le)幾種甲基化藥物(wù),有時(shí)人(rén)們會在藥物(wù)的代謝(xiè)熱(rè)點附近修飾甲基,例如(rú)臨床用于治療高膽固醇血症、冠心病的藥物(wù)simvastatin,其側鏈酯基α位修飾另一(yī)個甲基後,受位阻效應影響,代謝(xiè)速率有所降低(dī),因而可(kě)延長(cháng)其半衰期,增加藥物(wù)作(zuò)用時(shí)間(jiān)。相反,如(rú)果候選藥物(wù)的半衰期過長(cháng),人(rén)們可(kě)能(néng)通(tōng)過甲基化引入新的代謝(xiè)熱(rè)點縮短其半衰期。
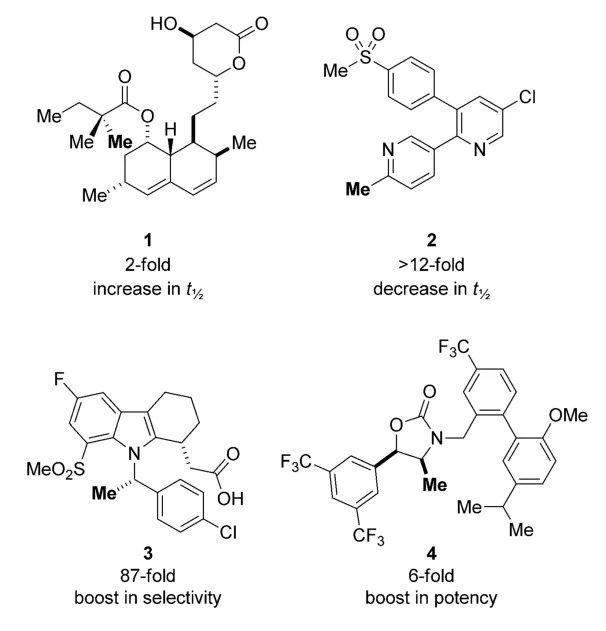
▲甲基化修飾(加重部分)對候選藥物(wù)分子的藥效優化(圖片來源:參考資料[1])
研究表明(míng),藥物(wù)分子中鄰近雜(zá)原子的位點(如(rú)α位)引入甲基通(tōng)常可(kě)以顯著改變其藥物(wù)活性,最為(wèi)簡單高效的方法是直接對相應位點的C-H鍵進行(xíng)甲基化,而有效控制反應的區(qū)域選擇性成為(wèi)必須解決的關鍵問(wèn)題。基于以往發展的甲基化反應,甲基往往需要(yào)在合成前期引入目标分子中,目前尚無通(tōng)用的手段可(kě)以實現複雜(zá)結構分子的後期修飾。這(zhè)也便意味着很(hěn)多母體化合物(wù)引入甲基需要(yào)從(cóng)頭合成,由此降低(dī)了(le)藥物(wù)研發中藥物(wù)分子甲基化的效率。

▲圖片來源:參考資料[2]
近年(nián)來,氮、氧等雜(zá)環化合物(wù)C(sp3)-H鍵烷基化反應的研究取得了(le)顯著的進展。雜(zá)環化合物(wù)通(tōng)常作(zuò)為(wèi)親核試劑與烷基親電試劑偶聯,後者具有良好的底物(wù)适用性。相比之下(xià),前者的适用範圍則相對有限。以甲基化反應為(wèi)例,簡單的氮雜(zá)環化合物(wù)可(kě)以順利實現特定位點的C(sp3)-H鍵烷基化,但(dàn)當底物(wù)結構較為(wèi)複雜(zá)或包含敏感的官能(néng)團時(shí),反應效果往往不夠理想。
M. Christina White教授團隊提出了(le)一(yī)種新的甲基化策略:首先在氮、氧雜(zá)環化合物(wù)的α位引入羟基,随後将其轉化為(wèi)相應的亞铵或氧鎓中間(jiān)體,此時(shí)α位具有較強的親電活性,便可(kě)順利與親核甲基化試劑反應得到最終産物(wù)。但(dàn)設計這(zhè)一(yī)過程存在以下(xià)問(wèn)題:目前,人(rén)們已發展了(le)一(yī)些方法實現雜(zá)環化合物(wù)的α-C(sp3)-H鍵羟基化,但(dàn)大多數(shù)工(gōng)作(zuò)中結構複雜(zá)的底物(wù)分子參與反應化學及區(qū)域選擇性較差。氮、氧雜(zá)環化合物(wù)α位氧化羟基化形成相應的半胺醛或半縮醛後,受超共轭活化作(zuò)用的影響,羟基常常會進一(yī)步氧化為(wèi)羰基,因而還需要(yào)額外(wài)的還原過程。此外(wài),半胺醛或半縮醛還可(kě)能(néng)發生消除等副反應。
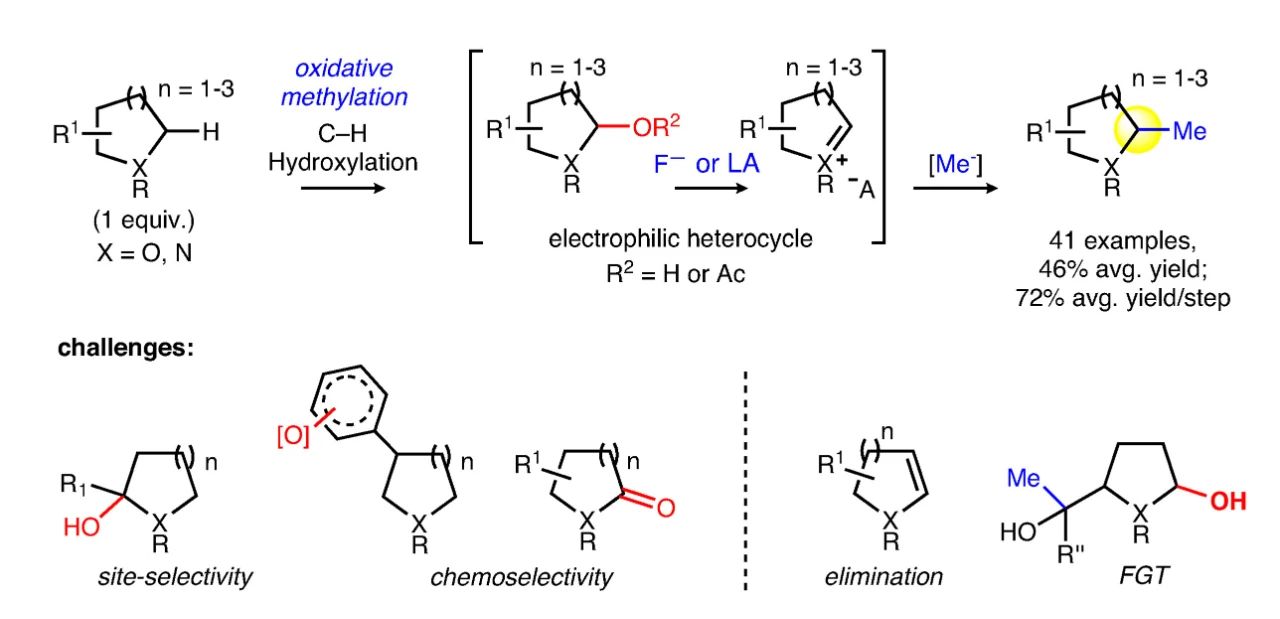
▲甲基化反應的設計思路及面臨的挑戰(圖片來源:參考資料[2])
2019年(nián),該團隊利用Mn催化劑1實現了(le)芳香烴分子中非活潑亞甲基C(sp3)-H鍵的高選擇性羟基化。反應具有良好的官能(néng)團兼容性,C(sp3)-H鍵發生氧化時(shí)芳香環中的C(sp2)-H鍵不會受到明(míng)顯的影響。不過,該方法僅适用于貧電子芳香烴,電中性或富電子芳香烴及部分雜(zá)芳香烴參與反應時(shí)效果仍需要(yào)改善。作(zuò)者設想将這(zhè)一(yī)催化體系用于雜(zá)環化合物(wù)的α-C(sp3)-H鍵羟基化。于是,他(tā)們首先以芳基化的γ-內(nèi)酰胺2作(zuò)為(wèi)模闆底物(wù),10 mol%的1作(zuò)為(wèi)催化劑,5當量的H2O2作(zuò)為(wèi)氧化劑,15當量的AcOH作(zuò)為(wèi)添加劑,反應得到大量羟基氧化為(wèi)酮羰基的産物(wù)4b;降低(dī)催化劑的負載量(0.5 mol%)與H2O2的用量(2當量),反應能(néng)以良好的收率得到相應的羟基化産物(wù),羟基不會發生進一(yī)步氧化。他(tā)們進一(yī)步選擇DAST或BF3·OEt2作(zuò)為(wèi)羟基的活化試劑,促進C-O鍵斷裂形成相應的亞铵中間(jiān)體。AlMe3作(zuò)為(wèi)親核甲基化試劑親核活性适中,可(kě)兼容其他(tā)親電活性較高的官能(néng)團,加上(shàng)Al原子具有一(yī)定的Lewis酸性,同樣可(kě)輔助C-O鍵斷裂。最終,作(zuò)者以理想的收率得到目标甲基化産物(wù),其他(tā)副反應途徑得到了(le)最大程度的抑制。
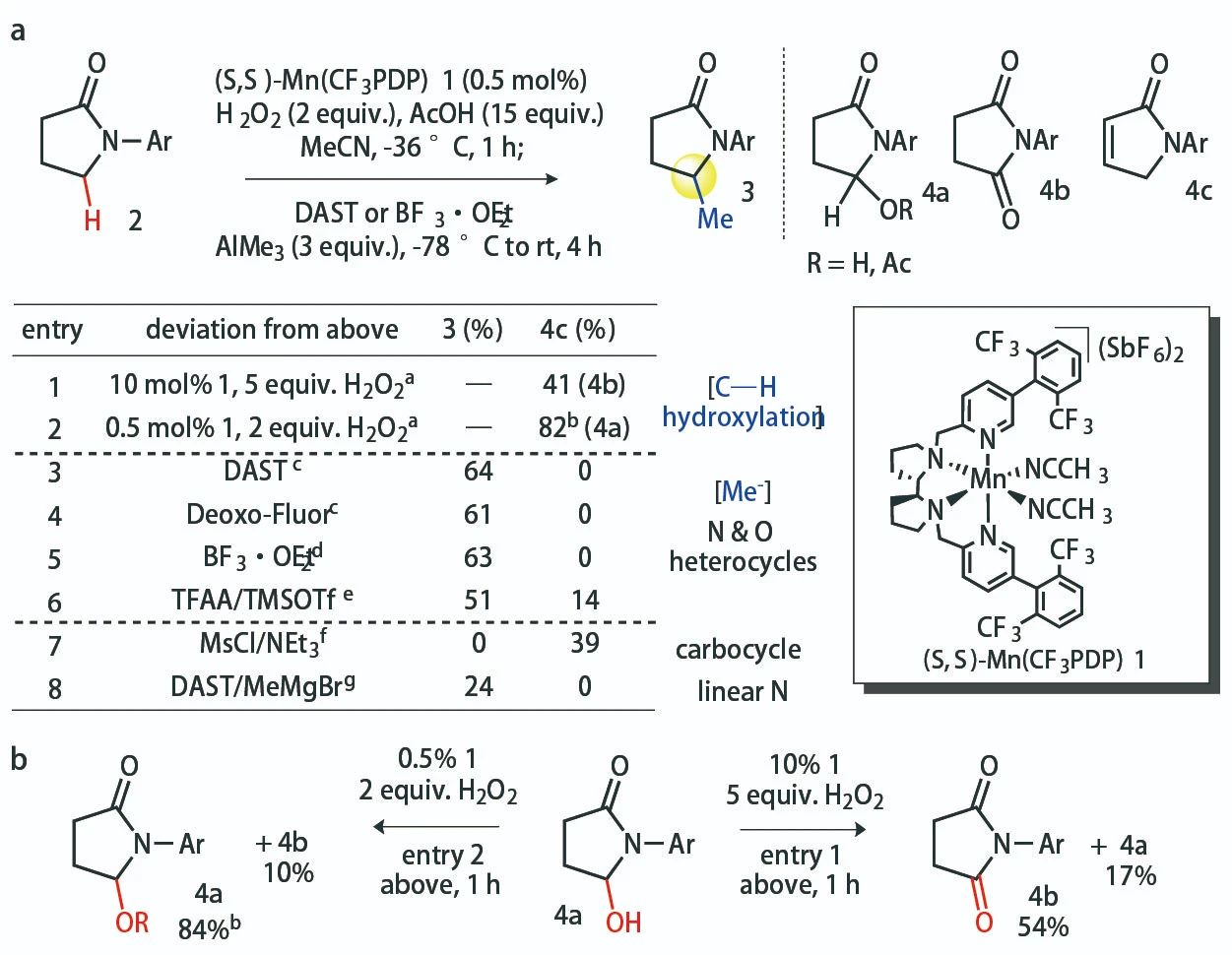
▲反應條件的篩選(圖片來源:參考資料[2])
這(zhè)種甲基化方法對于內(nèi)酰胺、噁唑烷酮、吡咯烷酮、哌啶等十餘種氮、氧雜(zá)環類化合物(wù)均具有良好的适用性,相應的結構在藥物(wù)分子中十分常見(jiàn)。反應擴大至克量級規模也不會對産率及選擇性帶來明(míng)顯的影響。而使用AlEt3作(zuò)為(wèi)乙基化試劑時(shí),同樣可(kě)以實現相應底物(wù)的乙基化。
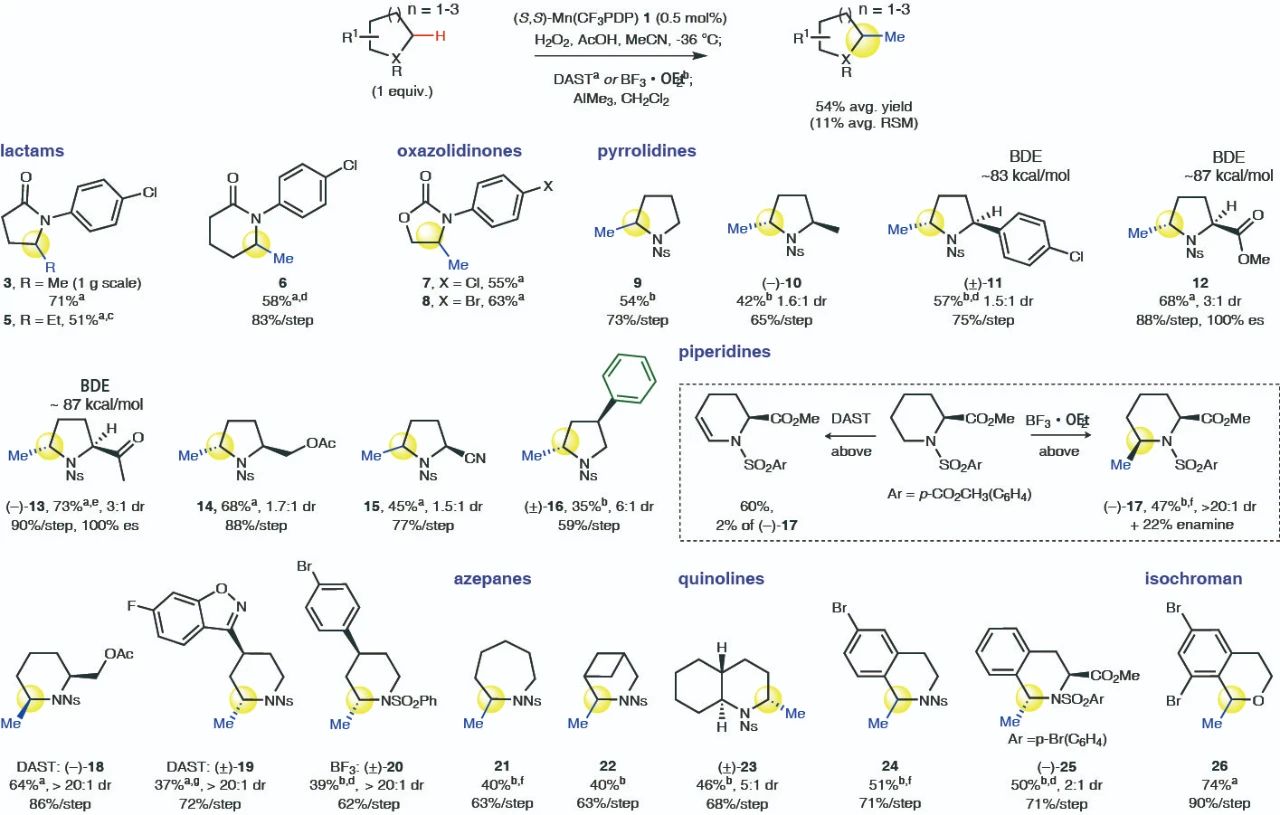
▲雜(zá)環底物(wù)适用範圍的考察(圖片來源:參考資料[2])
該反應還可(kě)用于天然産物(wù)及複雜(zá)結構藥物(wù)分子的後期修飾,大部分情況下(xià)均能(néng)良好的産率及選擇性得到α-甲基化的産物(wù)。
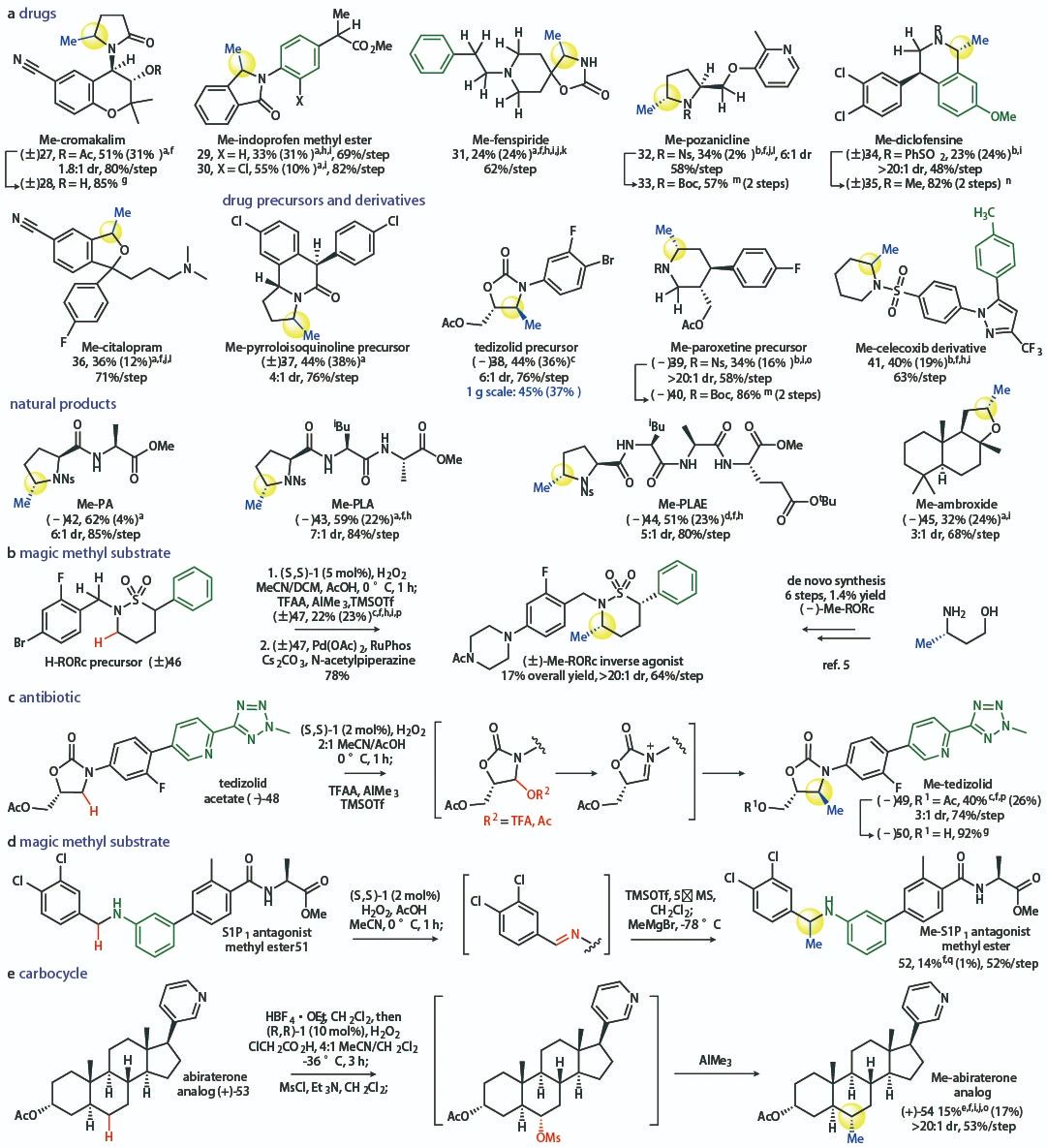
▲複雜(zá)結構分子的後期甲基化修飾(圖片來源:參考資料[2])
參考資料
[1] Heike Schönherr et al., (2013). Profound methyl effects in drug discovery and a call for new C-H methylation reactions. Angew. Chem. Int. Ed., DOI: 10.1002/anie.201303207[2] Kaibo Feng et al., (2020). Late-stage oxidative C(sp3)–H methylation. Nature, DOI: 10.1038/s41586-020-2137-8