
本文由藥明(míng)康德內(nèi)容團隊編輯
拯救脫發!禮來JAK抑制劑獲FDA突破性療法認定
禮來(Eli Lilly and Company)和(hé)Incyte公司聯合宣布,美國(guó)FDA已授予其JAK抑制劑baricitinib突破性療法認定,治療斑秃(alopecia areata)患者。新聞稿指出,baricitinib有潛力成為(wèi)首款FDA批準治療斑秃患者的療法。

Baricitinib是一(yī)款每日一(yī)次的口服JAK抑制劑,它已經獲得美國(guó)FDA的批準,治療對TNF抑制劑療法反應不足的中重度活動性類風(fēng)濕性關節炎患者。JAK蛋白激酶家族包括JAK1、JAK2、JAK3和(hé)TYK2四個成員(yuán)。它們在介導炎症性細胞因子的信号傳遞方面起到重要(yào)作(zuò)用。
該突破性療法的認定是基于名為(wèi)BRAVE-AA1的2/3期臨床研究的積極數(shù)據,該研究評估了(le)baricitinib治療斑秃患者的療效與安全性。在該項試驗的2期試驗部分沒有發現新的安全性問(wèn)題。基于它的中期數(shù)據,該試驗的3期試驗部分和(hé)一(yī)項附加的3期試驗目前正在進行(xíng)中。
小細胞肺癌添“勁敵”!Imfinzi組合療法提高患者總生存期
阿斯利康(AstraZeneca)公司宣布,其免疫療法Imfinzi(durvalumab),結合标準護理方法,在一(yī)線治療廣泛期小細胞肺癌(ES-SCLC)患者的3期臨床試驗CASPIAN的最終分析中,顯示出對患者總生存期(OS)持續顯著的改善。
Imfinzi是一(yī)款人(rén)源化抗PD-L1單克隆抗體,它通(tōng)過防止PD-L1與PD-1和(hé)CD80受體的結合,解除免疫抑制,增強人(rén)體免疫系統對抗癌症的能(néng)力。它已經獲得FDA批準,治療經治晚期膀胱癌患者,和(hé)經治3級(stage 3)無法切除的非小細胞肺癌(NSCLC)患者。Imfinzi與化療構成的組合療法治療廣泛期SCLC患者的補充生物(wù)制品許可(kě)申請(qǐng)已經獲得美國(guó)FDA授予的優先審評資格,有望在今年(nián)第一(yī)季度獲得批準。

在名為(wèi)CASPIAN的開(kāi)放标簽、随機、全球性3期臨床試驗中,廣泛期SCLC患者接受了(le)基于Imfinzi的組合療法或者标準化療組合的治療。Imfinzi組合療法包括:Imfinzi+依托泊苷(etoposide)+鉑基化療選擇(順鉑或卡鉑),或者Imfinzi+tremelimumab(抗CTLA-4抗體)+化療。該試驗結果顯示,Imfinzi的組合療法可(kě)以使患者得到具有臨床意義的總生存期改善。添加了(le)抗CTLA-4抗體的組合療法沒有達到試驗的主要(yào)終點。該試驗的詳細數(shù)據将在未來的醫(yī)學會議(yì)上(shàng)公布。
慢(màn)性咳嗽不用愁!默沙東P2X3受體拮抗劑達到3期試驗終點
默沙東(MSD)公司宣布,其口服選擇性P2X3受體拮抗劑gefapixant(MK-7264),在治療頑固性或無法解釋的慢(màn)性咳嗽成人(rén)患者的兩項關鍵性3期臨床試驗COUGH-1和(hé)COUGH-2中,達到主要(yào)療效終點。與安慰劑相比,gefapixant的治療顯著減少(shǎo)患者的咳嗽頻(pín)率。
Gefapixant是一(yī)種口服選擇性P2X3受體拮抗劑。P2X3受體的過度活化與感覺神經元的超敏化(hyper-sensitization)有關。損傷或感染引發的氣道(dào)和(hé)肺部神經元超敏反應可(kě)引起過度、持續和(hé)頻(pín)繁的咳嗽。
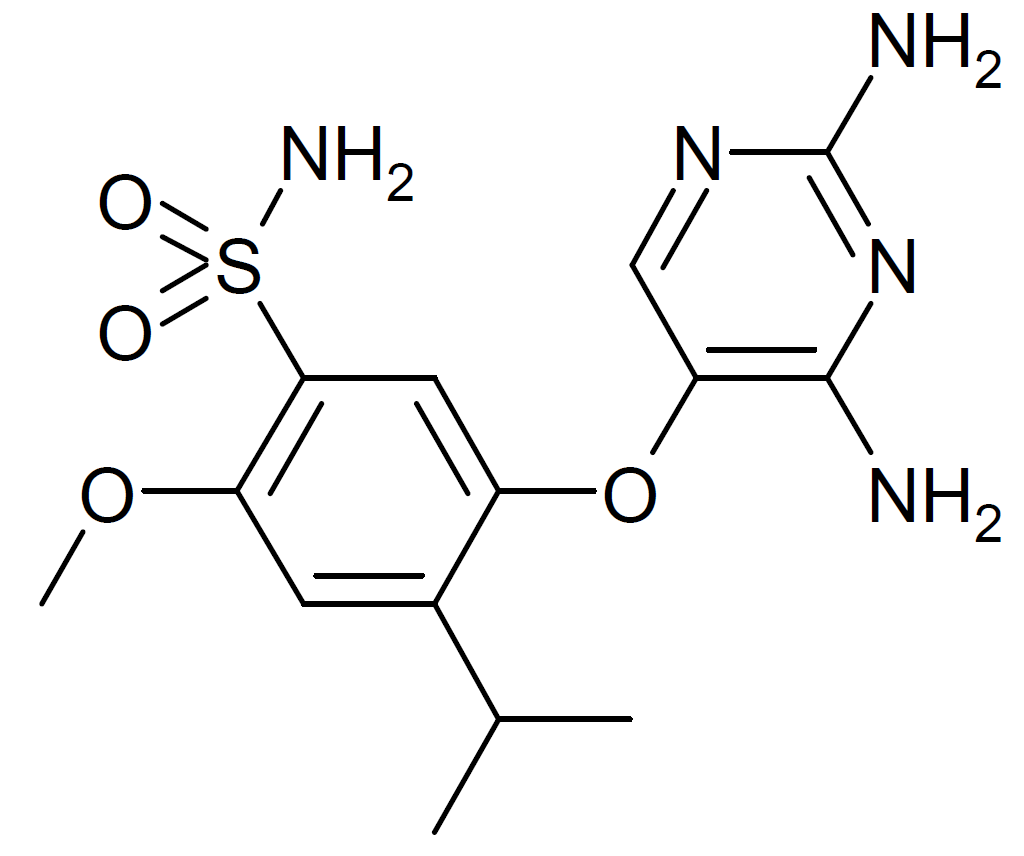
▲Gefapixant分子結構式(圖片來源:Meodipt / Public domain)
COUGH-1和(hé)COUGH-2是兩項随機、雙盲、含安慰劑對照組的3期臨床研究,旨在評估gefapixant降低(dī)難治性或無法解釋的慢(màn)性咳嗽成人(rén)患者咳嗽頻(pín)率的有效性和(hé)安全性。共有732名和(hé)1317名患者分别參與這(zhè)兩項研究。其主要(yào)研究終點是在第12周和(hé)第24周,使用動态數(shù)字錄音設備評估的24小時(shí)內(nèi)咳嗽頻(pín)率。試驗結果顯示,與安慰劑組相比,治療組中患者的咳嗽頻(pín)率達到統計學意義上(shàng)的顯著減少(shǎo),即該試驗的主要(yào)研究終點。
瞄準“不限癌種”療法!輝瑞聯手IDEAYA
專注于癌症精準治療的醫(yī)藥公司IDEAYA Biosciences宣布,已與輝瑞(Pfizer)簽訂一(yī)項臨床研發合作(zuò)協議(yì),以評估IDEAYA公司的在研蛋白激酶C(PKC)小分子抑制劑IDE196和(hé)輝瑞的MEK抑制劑binimetinib聯用,治療攜帶GNAQ或GNA11基因突變的實體瘤患者中的療效,其中包括轉移性葡萄膜黑(hēi)色素瘤(MUM)、皮膚黑(hēi)色素瘤和(hé)結直腸癌(CRC)患者。
IDEAYA公司研發的IDE196是靶向PKC的小分子抑制劑。PKC蛋白激酶家族,位于MEK/MAPK信号通(tōng)路的上(shàng)遊,G蛋白信号通(tōng)路的下(xià)遊。PKC參與影響細胞增殖或轉錄調節的信号傳導。無論是上(shàng)遊的GNAQ或GNA11的基因突變,還是PRKC基因融合,都(dōu)可(kě)導緻PKC被持續性激活,從(cóng)而誘發癌症。
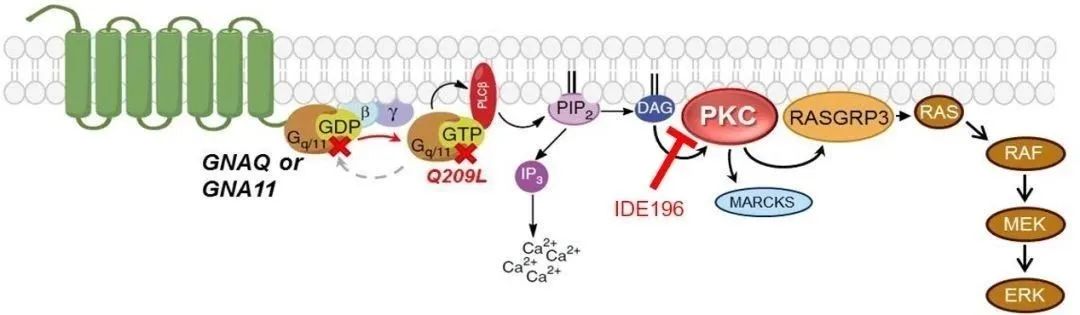
▲IDE196的藥物(wù)機理示意圖(圖片來源:IDEAYA官網)
IDEAYA和(hé)輝瑞将組成一(yī)個聯合開(kāi)發委員(yuán)會(JDC),雙方将就臨床試驗結果進行(xíng)聯合決策和(hé)數(shù)據共享。IDEAYA将贊助這(zhè)項研究,輝瑞公司将為(wèi)該研究提供binimetinib。該研究将評估通(tōng)過在上(shàng)遊PKC和(hé)下(xià)遊MEK兩個結點處抑制MAP激酶信号通(tōng)路治療攜帶GNAQ或GNA11基因突變的實體瘤患者的緩解率、療效和(hé)持久性。此外(wài),該臨床試驗還将研究每種藥物(wù)的藥代動力學和(hé)聯合用藥的耐受性。預計該試驗将在2020年(nián)中期開(kāi)始。
“亮劍”多系統萎縮!口服MPO抑制劑獲快(kuài)速通(tōng)道(dào)資格
Biohaven Pharmaceuticals公司宣布,其口服髓過氧化物(wù)酶(MPO)抑制劑verdiperstat(BHV-3241)已獲得美國(guó)FDA授予的快(kuài)速通(tōng)道(dào)資格,用于治療多系統萎縮(MSA)患者。
MPO是氧化和(hé)炎症過程的關鍵驅動因素,它在一(yī)系列腦部疾病中顯著增加。抑制MPO的活性是治療神經炎症和(hé)神經退行(xíng)性疾病(包括MSA)的一(yī)種頗具前景的策略。研究發現,MPO水平升高與多發性硬化症和(hé)阿爾茨海(hǎi)默病也有關聯。Verdiperstat正是一(yī)款在研口服MPO抑制劑,Biohaven公司于2018年(nián)從(cóng)阿斯利康(AstraZeneca)公司獲得該藥物(wù)的研發許可(kě)。該藥物(wù)目前已獲得美國(guó)FDA和(hé)歐洲藥品管理局授予的孤兒藥資格。
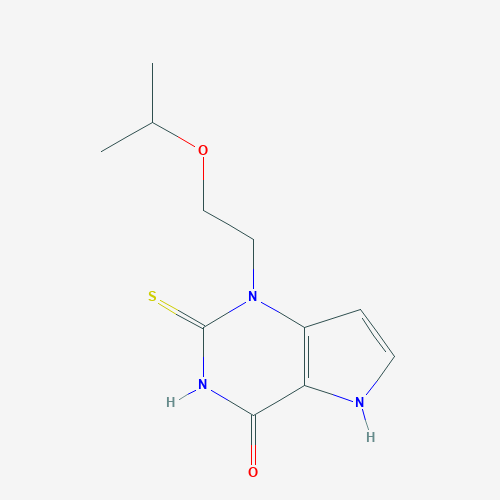
▲Verdiperstat分子結構式(圖片來源:PubChem)
此前的2a期臨床試驗初步結果顯示,通(tōng)過統一(yī)MSA評定量表測量的主要(yào)療效結果有所改善。經過12周的治療後,安慰劑組患者評分下(xià)降了(le)4.6分,而使用每日兩次300 mg BHV3241的患者分數(shù)下(xià)降了(le)3.7分,使用每日兩次600 mg BHV3241的患者分數(shù)下(xià)降了(le)2.6分。其他(tā)測量結果(比如(rú)綜合自(zì)主症狀評分和(hé)MSA生活質量量表)也得到相應的改善。這(zhè)些臨床發現與在動物(wù)模型中觀察到的verdiperstat的神經保護作(zuò)用一(yī)緻。Verdiperstat顯著降低(dī)了(le)人(rén)體血液中的MPO活性,這(zhè)是該藥物(wù)與其靶标結合的生物(wù)标志物(wù)。目前,該藥物(wù)正在一(yī)項3期臨床試驗中評估其療效與安全性。
阻擊肺炎球菌感染!輝瑞20價疫苗3期臨床數(shù)據積極
輝瑞(Pfizer)公司宣布,其在研20價肺炎鏈球菌偶聯(20vPnC)疫苗,在預防由肺炎鏈球菌感染引起的肺炎和(hé)侵襲性疾病的3期臨床試驗中,對18歲及以上(shàng)成人(rén)顯示出與已獲批疫苗Prevnar 13相當的安全性和(hé)免疫原性。

偶聯疫苗(conjugate vaccine)是通(tōng)過化學方法将多糖或寡糖抗原,偶聯到蛋白質載體上(shàng)。它能(néng)夠更好地(dì)刺激成人(rén)與兒童的免疫反應,從(cóng)而促使B細胞生産IgG抗體。偶聯疫苗有望對多種傳染性疾病的預防産生重要(yào)作(zuò)用。
輝瑞公司的開(kāi)發的20vPnC疫苗包括Prevnar 13中含有的13種血清型,與另外(wài)7種新血清型。7種新增加的血清型是侵襲性肺炎球菌疾病(IPD)的全球病因,與高病死率、抗生素耐藥性和(hé)/或腦膜炎的發生相關。此前,美國(guó)FDA曾授予20vPnC疫苗快(kuài)速通(tōng)道(dào)資格和(hé)突破性療法認定。
這(zhè)項随機、雙盲的3期臨床研究共有3880名此前未接種過肺炎鏈球菌疫苗的18歲及以上(shàng)成人(rén)參與。試驗結果顯示,與Prevnar 13相比,接種20vPnC疫苗一(yī)個月後,試驗組中60歲及以上(shàng)成年(nián)人(rén)的13種血清型均達到了(le)免疫原性的非劣效性标準。與另一(yī)種已上(shàng)市的疫苗PPSV23中含有的七種新血清型相比,接種20vPnC疫苗的60歲及以上(shàng)成年(nián)人(rén)中,六種血清型達到了(le)免疫原性的非劣效性标準。18歲至59歲成人(rén)與60歲至64歲成人(rén)在20種血清型上(shàng)均達到非劣效性标準。輝瑞公司将在未來公布其對20vPnC疫苗的安全性和(hé)免疫原性的全面分析結果。
破解濕疹困擾!輝瑞JAK1抑制劑達到3期臨床終點
輝瑞(Pfizer)公司宣布,其口服JAK1抑制劑abrocitinib,在治療中重度特應性皮炎(AD)成人(rén)患者的3期臨床試驗JADE COMPARE中,達到了(le)主要(yào)研究終點。Abrocitinib的治療使患者的皮膚症狀清除率、疾病嚴重程度,以及瘙癢方面均有所改善。輝瑞公司預計将在今年(nián)晚些時(shí)候向監管機構遞交新藥申請(qǐng)。
輝瑞的abrocitinib是一(yī)種口服小分子特異性JAK1抑制劑。JAK1抑制劑通(tōng)過調節多種與特應性皮炎病理相關的細胞因子來控制病情,包括白細胞介素IL-4,IL-13,IL-31和(hé)幹擾素γ。之前,abrocitinib已經獲得美國(guó)FDA授予的突破性療法認定。
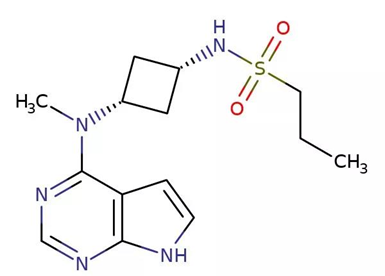
▲Abrocitinib的分子結構式(圖片來源:ChemIDplus)
在這(zhè)項3期臨床研究中,中重度特應性皮炎患者在接受外(wài)用療法的同時(shí),接受abrocitinib,活性對照(dupilumab),或安慰劑的治療。JADE COMPARE研究的結果顯示,接受兩種不同劑量abrocitinib治療的患者在第12周達到主要(yào)療效終點的比例,顯著優于安慰劑組,這(zhè)一(yī)療效在第16周得到維持。此外(wài),在治療的第2周,200毫克abrocitinib治療組中患者的瘙癢症狀得到改善的比例要(yào)高于活性對照組,但(dàn)100毫克abrocitinib治療組中患者的這(zhè)一(yī)數(shù)據未達到統計學意義上(shàng)的顯著改善。該試驗的詳細數(shù)據預計将在未來的醫(yī)學會議(yì)上(shàng)公布。
裏程碑!一(yī)月一(yī)針長(cháng)效HIV創新療法獲全球首批
ViiV Healthcare公司宣布,加拿(ná)大衛生部(Health Canada)批準該公司開(kāi)發的長(cháng)效HIV-1療法Cabenuva上(shàng)市,用于在HIV-1病毒已經得到抑制的患者中替代已有的抗病毒治療方案。Cabenuva是世界上(shàng)首款隻需每月一(yī)針,就能(néng)有效抑制HIV-1病毒的完整長(cháng)效治療方案。它将患者每年(nián)接受治療的天數(shù)從(cóng)365天降為(wèi)12天。新聞稿指出,這(zhè)是Cabenuva在全球首次獲批。

ViiV Healthcare公司開(kāi)發的Cabenuva是一(yī)款肌肉注射的長(cháng)效抗病毒療法。它由兩種有效成分構成,分别為(wèi)利匹韋林(rilpivirine),和(hé)卡博特韋(cabotegravir)。利匹韋林是一(yī)款口服非核苷逆轉錄酶抑制劑。卡博特韋是一(yī)款整合酶抑制劑,它的作(zuò)用是抑制病毒DNA整合到人(rén)體免疫細胞的基因組中。這(zhè)一(yī)整合步驟是HIV病毒複制過程中不可(kě)缺少(shǎo)的一(yī)步,也是導緻慢(màn)性感染的重要(yào)原因。
Cabenuva的批準是基于包含16個國(guó)家的超過1100名患者的兩項關鍵性3期臨床試驗的結果。這(zhè)兩項名為(wèi)ATLAS和(hé)FLAIR的臨床試驗的結果已經在本月發表在《新英格蘭醫(yī)學雜(zá)志》(NEJM)上(shàng)。研究結果表明(míng),每月一(yī)次,臀部肌肉注射Cabenuva,與每日服用口服抗病毒療法相比,治療48周後,在抑制患者體內(nèi)HIV-1病毒RNA水平方面效果相當。加拿(ná)大衛生部同時(shí)還批準了(le)卡博特韋的口服片劑Vocabria,作(zuò)為(wèi)接受Cabenuva長(cháng)效療法之前的導入療法。
對參加這(zhè)兩項臨床試驗的部分患者進行(xíng)的問(wèn)卷調查表明(míng),在接受治療48周之後,回答(dá)問(wèn)卷的532名患者中523名(98%)更傾向于使用Cabenuva,9名(2%)更傾向于使用原先的口服抗病毒療法,另有59名患者未對問(wèn)卷做(zuò)出回答(dá)。
注:本文旨在介紹醫(yī)藥健康研究進展,不是治療方案推薦。如(rú)需獲得治療方案指導,請(qǐng)前往正規醫(yī)院就診。
版權說明(míng):本文來自(zì)藥明(míng)康德內(nèi)容團隊,轉載授權請(qǐng)在「藥明(míng)康德」微(wēi)信公衆号回複“轉載”,獲取轉載須知。