
本文由醫(yī)拓原創,在“國(guó)際肝膽資訊”公衆号上(shàng)發表
2020年(nián)3月20日,對于膽管癌來說又是一(yī)個載入史冊的日子。首個靶向藥Pemigatinib二線治療局晚期或轉移性膽管癌的Ⅱ期臨床試驗于國(guó)際頂級期刊《柳葉刀·腫瘤學》(The Lancet Oncology)正式發表!Pemigatinib是靶向FGFR2融合/重排的膽管癌患者,治療既往一(yī)線治療進展的膽管癌患者,疾病控制率DCR為(wèi)82%,完全緩解率CR為(wèi)2.8%!相信對于很(hěn)多膽管癌患者來說都(dōu)是振奮人(rén)心的好消息,雖然有一(yī)線标準化療方案,但(dàn)是有效率太低(dī)又易複發。該臨床研究的發表無疑給膽管癌治療領域注入了(le)一(yī)劑強心劑!給膽管癌患者樹(shù)立起堅實的後盾!

Pemigatinib:二線治療FGFR2融合/重排的膽管癌患者,DCR為(wèi)82%
該試驗FIGHT-202,是一(yī)個開(kāi)放、單臂二線治療晚期膽管癌患者的Ⅱ期研究,共納入146例經過≥1線治療的晚期膽管癌患者,這(zhè)些患者既往不能(néng)接受過選擇性FGFR抑制劑治療。
分為(wèi)3個隊列:A是FGFR2融合/重排(n=107,98%為(wèi)肝內(nèi)膽管癌患者),B是其他(tā)FGFR突變(n=20),C是非FGFR突變(n=18),1名患者未定。所有患者均接受Pemigatinib治療(13.5 mg qd 用2周歇1周)。
該試驗主要(yào)研究終點是評估FGFR2融合或重排患者的客觀反應率ORR。次要(yào)終點是分析所有患者中ORR和(hé)反應持續時(shí)間(jiān)DOR,疾病控制率DCR、無進展生存期PFS、總生存期OS、安全性的。
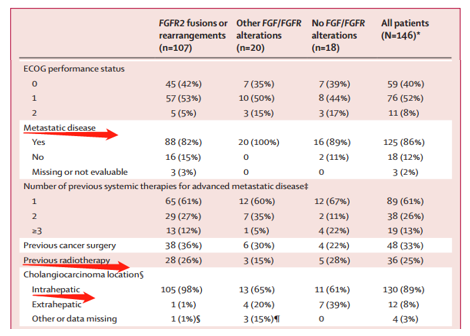
主要(yào)研究終點:
1) A組ORR為(wèi)35.5%,其中3例患者完全緩解(CR),CR率為(wèi)2.8% ,部分反應率為(wèi)32.7%,DCR為(wèi)82%,DOR中位數(shù)為(wèi)7.5個月。而B、C組ORR為(wèi)0。也就是說pemigatinib隻針對FGFR2融合/重排。
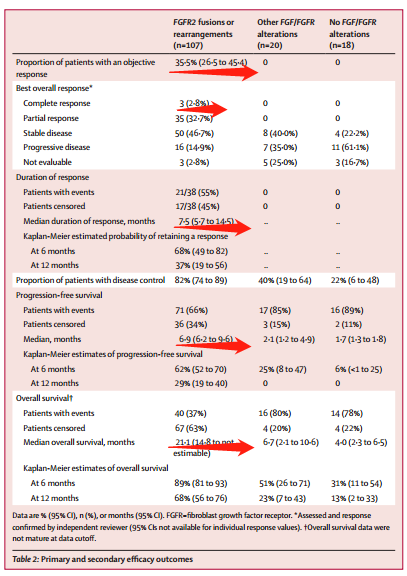
2)中位PFS
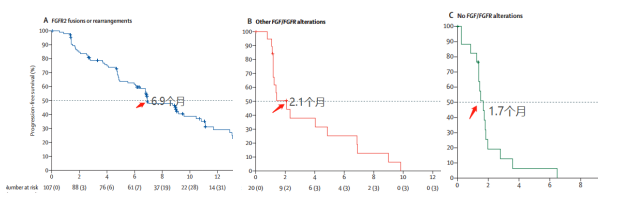
A組、B組、C組的中位PFS分别為(wèi)6.9 ,2.1和(hé)1.7個月
3)中位OS
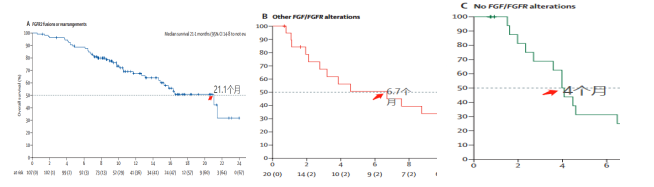
A組、B組、C組的中位OS分别為(wèi)21.1、6.7和(hé)4個月。A組最長(cháng)!
A組相比其他(tā)兩個隊列,生存期得到大幅度延長(cháng),意味着的患者用Pemigatinib治療效果非常不錯。
不良反應:
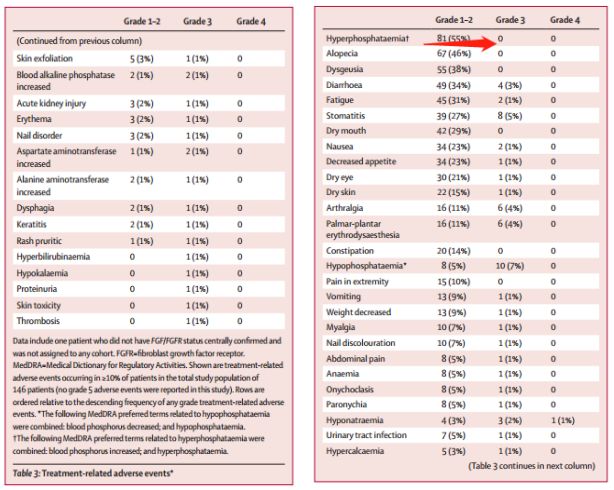
1-2級最常見(jiàn)不良反應是高磷血症(55%),其他(tā)包括脫發(46%),腹瀉(38%),疲勞(31%)和(hé)味覺障礙(29%)。
3-4級不良反應發生率為(wèi)65%,其中最常見(jiàn)不良反應是低(dī)磷血症(12%),其餘為(wèi)關節痛(6%),口腔炎(5%),低(dī)鈉血症(5%),腹痛(5%)和(hé)疲勞(5%)。
基于這(zhè)些令人(rén)鼓舞(wǔ)的結果,2019年(nián)11月,美國(guó)FDA正式受理pemigatinib用于治療複發的FGFR2基因融合或重排的局部晚期膽管癌的新藥上(shàng)市申請(qǐng)(NDA),并授予其優先審評資格。該藥預計5月底就在國(guó)外(wài)上(shàng)市。國(guó)內(nèi)的膽管癌患者不用心急,目前該藥已經完成國(guó)內(nèi)患者的首例給藥,目前我們平台也在開(kāi)展pemigatinib的臨床招募,想要(yào)報名的患者,點擊文末閱讀原文報名。
Pemigatinib除了(le)二線治療膽管癌患者,在一(yī)線也展開(kāi)了(le)一(yī)項名為(wèi)FIGHT 302III期研究,該研究是頭對頭比較,Pemigatinib與吉西(xī)他(tā)濱聯合順鉑化療一(yī)線治療不可(kě)手術(shù)切除或轉移性的伴FGFR2重排晚期膽管癌患者的療效。靜待佳音!
參考文獻:
https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(20)30109-1/fulltext