
本文由雙胍原創,在 科志康醫(yī)藥公衆号上(shàng)發表
2020年(nián)3月25日,美國(guó)FDA向輝瑞印度子公司Pfizer Healthcare India(即Hospira Healthcare India)發出警告信【1】,原因是無菌注射劑的無菌生産、檢測以及數(shù)據完整性方面的嚴重質量缺陷。筆(bǐ)者發現,該公司早在2019年(nián)3月4日就因類似問(wèn)題受到過FDA警告【2】,讓人(rén)不禁要(yào)問(wèn),輝瑞這(zhè)家印度子公司到底怎麽了(le)?
自(zì)2010年(nián)至截稿時(shí)間(jiān),輝瑞共接受FDA CDER對其藥品質量保證體系進行(xíng)的現場檢查共106次,其中零缺陷(NAI)36次,自(zì)願整改(VAI)59次,強制整改(OAI)11次,強制整改的比例約為(wèi)10.4%,和(hé)10年(nián)間(jiān)FDA CDER對我國(guó)藥企現場檢查中OAI的比例相似,見(jiàn)圖1,似與輝瑞這(zhè)樣的國(guó)際制藥巨頭身份不符。
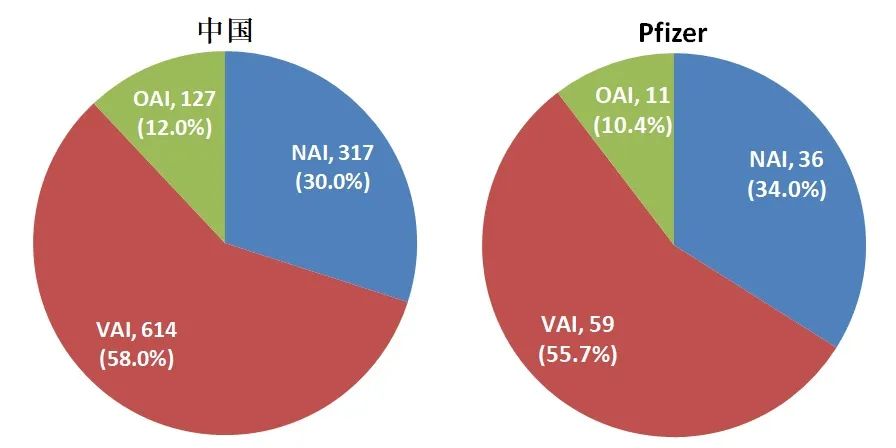
圖1. 2010年(nián)至今,中國(guó)藥企和(hé)輝瑞接受CDER檢查結果彙總
11次OAI中(見(jiàn)表1),有1次是2011年(nián)的Pfizer Pharmaceuticals,經整改在随後2013、2015、2016、2018和(hé)2019年(nián)的連續5次現場檢查都(dōu)以VAI結果通(tōng)過;另10次分别是輝瑞在美國(guó)的子公司Meridian Medical Technologies(6次)和(hé)在印度的子公司Pfizer Healthcare India(4次)。經調查發現,這(zhè)兩家公司都(dōu)是輝瑞并購的子公司。
表1. 11次OAI結果所涉及的輝瑞企業統計
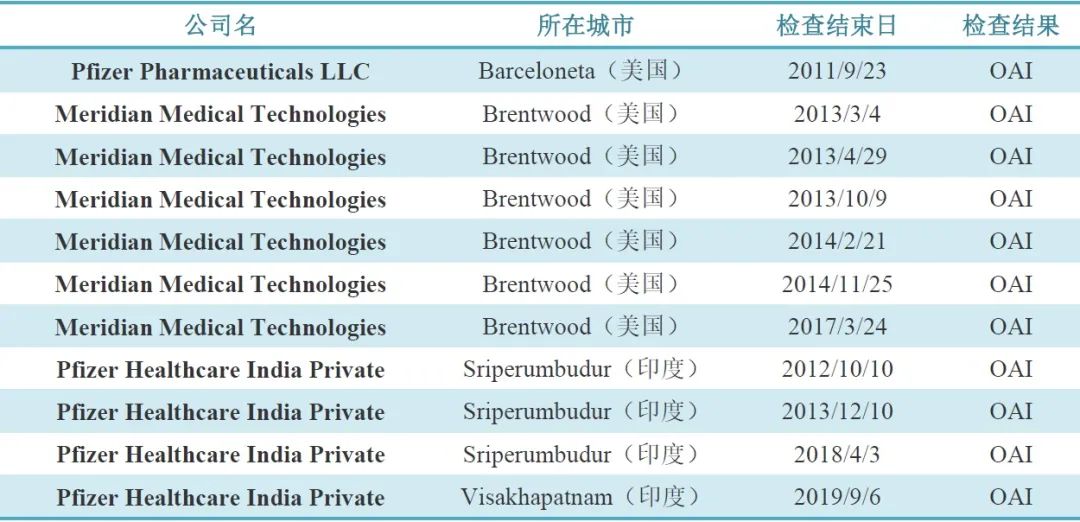
Meridian Medical Technologies于2009年(nián)被輝瑞收購,負責生産急救藥EpiPen(腎上(shàng)腺素自(zì)動注射産品),于2017年(nián)9月收到FDA警告信【3】,稱該公司制造環節存在嚴重的違規情況,未能(néng)夠徹底調查産品及成分與規定标準不符或差異情況;未建立充分書(shū)面規程,描述如(rú)何處理所有關于藥品的書(shū)面和(hé)口頭投訴并遵守;企業重複違規(2013年(nián)、2014年(nián)FDA頻(pín)繁檢查該企業結果都(dōu)是OAI)證明(míng)企業對其産品的生産和(hé)監控不充分。
Hospira于2015年(nián)被輝瑞收購,其印度子公司改名為(wèi)Pfizer Healthcare India,在印度有3家工(gōng)廠,分别位于Aurangabad,Sriperumbudur和(hé)Visakhapatnam。其中,Aurangabad工(gōng)廠最近一(yī)次檢查是在2018年(nián)8月以VAI結果通(tōng)過。Sriperumbudur工(gōng)廠在2012、2013和(hé)2018年(nián)連續三次被警告,當前可(kě)能(néng)處于關閉狀态。Visakhapatnam工(gōng)廠近年(nián)接受過多次FDA檢查,在2014年(nián)、2015年(nián)、2017年(nián)和(hé)2018年(nián)連續5次都(dōu)以VAI結果通(tōng)過,但(dàn)2019年(nián)為(wèi)OAI,并同時(shí)上(shàng)了(le)警告信。這(zhè)次檢查中,FDA檢查員(yuán)發現Visakhapatnam工(gōng)廠未充分調查無菌檢測不合格的根本原因,也沒有有效實施CAPA來解決無菌檢測缺陷,例如(rú),雖然調查了(le)批次某藥品注射劑無菌檢查失敗原因(此批被拒),認為(wèi)最可(kě)能(néng)是因為(wèi)“缺乏某藥品完整性測試”,同時(shí)還指出了(le)可(kě)能(néng)的微(wēi)生物(wù)污染來源。但(dàn)是,Visakhapatnam工(gōng)廠未做(zuò)調整,CAPA實施的及時(shí)性不足。此外(wài),Visakhapatnam工(gōng)廠也沒有充分調查微(wēi)生物(wù)實驗室條件和(hé)操作(zuò)中的嚴重缺陷。FDA在警告信中強調已知Visakhapatnam工(gōng)廠将于2020年(nián)7月啓用自(zì)動化完整性測試,還聘請(qǐng)了(le)一(yī)名顧問(wèn)來審核操作(zuò)并協助滿足FDA的要(yào)求。但(dàn)FDA強調應該盡快(kuài)提供以下(xià)內(nèi)容:
1. 對整個系統(包括超限結果、偏差調查、投訴和(hé)故障等)進行(xíng)全面評估。提供修複此系統的詳細操作(zuò)計劃。行(xíng)動計劃應包括但(dàn)不限于調查能(néng)力、範圍确定、根本原因評估、CAPA有效性、質量保證監督和(hé)書(shū)面程序方面的重大改進。說明(míng)将如(rú)何确保調查的所有階段都(dōu)得到适當的執行(xíng)。2. 為(wèi)CAPA計劃制定評估和(hé)補救計劃。提供一(yī)份報告,評估是否有效地(dì)進行(xíng)根本原因分析,确保CAPA的有效性,定期審查調查趨勢,在需要(yào)時(shí)對CAPA計劃進行(xíng)改進,确保适當的質量保證決策權,并得到執行(xíng)管理層的充分支持。3. 對生産過程和(hé)檢測過程中使用的文件系統進行(xíng)全面評估,以确定文件實踐不足之處,确保整個經營過程中保留可(kě)追溯的、清晰的、完整的、原始的、準确的、同期的記錄。4. 對實驗室操作(zuò)、程序、方法、設備、文件、分析能(néng)力和(hé)資源進行(xíng)全面、獨立的評估。
除印度工(gōng)廠外(wài),位于美國(guó)的Mcpherson的Hospira Inc,自(zì)2015年(nián)被輝瑞并購後,在2016和(hé)2018年(nián)兩次現場檢查中結果也都(dōu)是OAI,被FDA警告。
專家觀點:
從(cóng)輝瑞子公司案例可(kě)以看(kàn)出,現場檢查時(shí)發現生産和(hé)實驗室檢測過程中存在系統性問(wèn)題後,想要(yào)快(kuài)速完成整改的難度相當大,即使有輝瑞這(zhè)樣的制藥巨頭作(zuò)為(wèi)依托,輝瑞子公司的整改之路也并不順利。然而,筆(bǐ)者發現,輝瑞在新加坡、加拿(ná)大、愛爾蘭、比利時(shí)、意大利和(hé)德國(guó)等地(dì)的企業又表現良好。
從(cóng)源頭着手,事半功倍;道(dào)理易懂(dǒng),但(dàn)做(zuò)到難。很(hěn)多企業往往習慣于亡羊補牢,在事發之後才采取措施。現代化企業,牽一(yī)發而動全身,企業質量體系整改并不像紮緊羊圈栅欄那(nà)麽簡單,更何況丢羊之後才行(xíng)動,就已經失了(le)先機損失了(le)羊。
筆(bǐ)者對輝瑞近10年(nián)迎檢情況進行(xíng)深度分析後發現,這(zhè)些頻(pín)繁的警告多發生在并購的子公司。在并購時(shí),藥企通(tōng)常會對被并購企業的産品、财務進行(xíng)全面盡調和(hé)評估,但(dàn)對藥品合規生産能(néng)力的評估可(kě)能(néng)未加以足夠重視(shì),結果将被并購企業在研發和(hé)生産上(shàng)的缺陷一(yī)起并入。
史上(shàng)最貴藥物(wù)之一(yī) ,制藥巨頭諾華的Zolgensma,也是并購過來的項目(來自(zì)其收購的美國(guó)企業AveXis),在獲批上(shàng)市僅兩個月後,就因質量合規問(wèn)題被FDA警告。
在全生命周期監管下(xià),藥企應将全生命周期合規性作(zuò)為(wèi)公司經營戰略,除了(le)研發和(hé)生産環節外(wài),還應在項目立項、引進和(hé)并購時(shí)建立法規戰略,識别法規風(fēng)險,降低(dī)項目運營的不确定性。筆(bǐ)者建議(yì),在并購項目和(hé)企業時(shí),可(kě)以将研發和(hé)生産的合規性作(zuò)為(wèi)評估指标之一(yī),同時(shí)在并購之後,持續關注藥品的合規生産狀況。
參考鏈接
【1】
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/pfizer-healthcare-india-private-limited-594972-03252020
【2】
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/hospira-healthcare-india-pvt-ltd-557890-03042019
【3】
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/meridian-medical-technologies-inc-pfizer-company-525881-09052017