
藥明(míng)康德內(nèi)容團隊編輯
今天,作(zuò)為(wèi)國(guó)際合作(zuò)試點項目Orbis的一(yī)部分,美國(guó)FDA批準Seattle Genetics公司開(kāi)發的HER2特異性抑制劑Tukysa(tucatinib)上(shàng)市,與曲妥珠單抗和(hé)卡培他(tā)濱聯用,用于治療手術(shù)無法切除或轉移性經治晚期HER2陽性乳腺癌成人(rén)患者。FDA發布的公告表示,這(zhè)一(yī)批準是FDA在Orbis項目下(xià)首次批準的新分子實體(NME),FDA也在這(zhè)一(yī)項目中首次與新加坡和(hé)瑞士的監管機構進行(xíng)了(le)合作(zuò)。Tukysa的新藥申請(qǐng)從(cóng)獲得優先審評資格到獲得批準隻花了(le)兩個月的時(shí)間(jiān),比預定時(shí)間(jiān)提前了(le)4個月!

HER2陽性乳腺癌約占乳腺癌患者總數(shù)的1/5,這(zhè)些腫瘤過度表達人(rén)類表皮生長(cháng)因子受體2(HER2),這(zhè)種蛋白會促進癌細胞的生長(cháng)。超過25%的轉移性HER2陽性乳腺癌女(nǚ)性患者會發生腦轉移。
Tukysa是一(yī)種口服酪氨酸激酶抑制劑,對HER2具有高度特異性,但(dàn)對同屬人(rén)表皮生長(cháng)因子受體家族的EGFR沒有明(míng)顯抑制作(zuò)用。以往的研究顯示,不論是作(zuò)為(wèi)單一(yī)療法還是與化療和(hé)其他(tā)HER2靶向藥物(wù)聯合使用,它都(dōu)顯示出抗癌活性。此前,它曾經獲得FDA授予的快(kuài)速通(tōng)道(dào)資格、孤兒藥資格和(hé)突破性療法認定。
Tukysa的批準是基于一(yī)項納入612例HER2陽性晚期不可(kě)切除或轉移性乳腺癌患者的臨床試驗結果,這(zhè)些患者既往接受過曲妥珠單抗、帕妥珠單抗和(hé)抗體偶聯藥物(wù)Kadcyla的治療,48%的入組患者在試驗開(kāi)始時(shí)出現腦轉移。
試驗結果表明(míng),接受Tukysa、曲妥珠單抗和(hé)卡培他(tā)濱治療的患者的中位無進展生存期(PFS)為(wèi)7.8個月,而接受安慰劑、曲妥珠單抗和(hé)卡培他(tā)濱治療的患者為(wèi)5.6個月。接受Tukysa組合療法治療的患者的中位總生存期(OS)為(wèi)21.9個月,對照組這(zhè)一(yī)數(shù)值為(wèi)17.4個月。
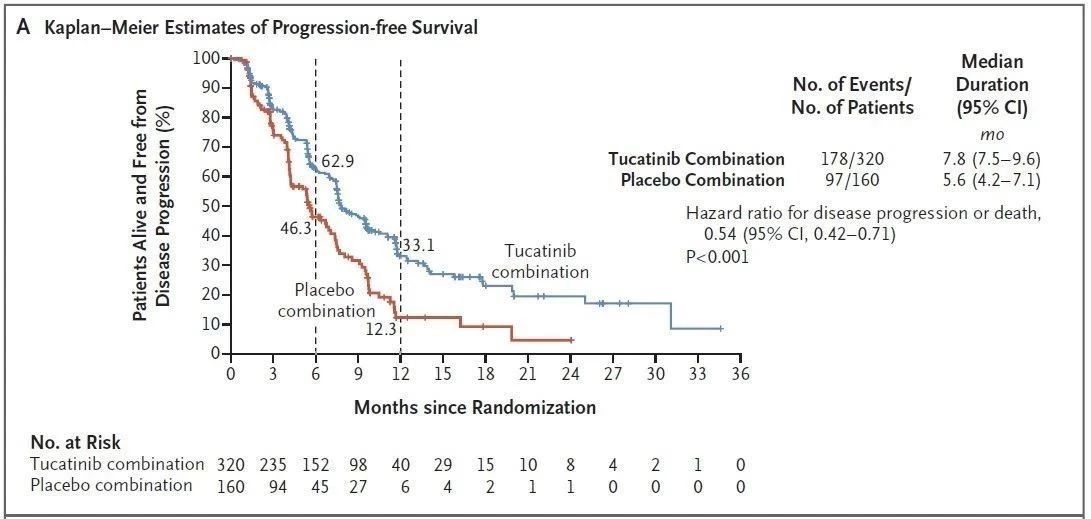
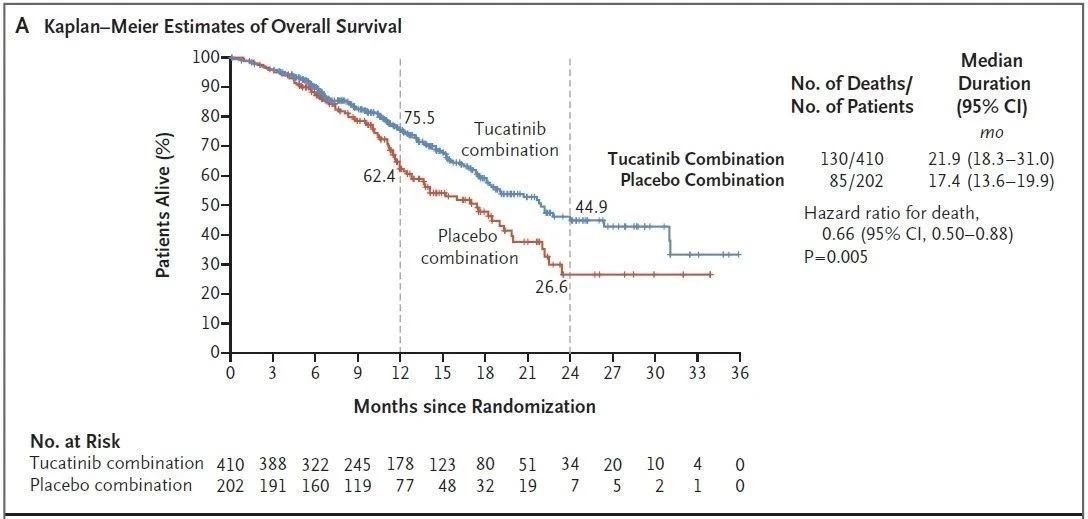
▲Tukysa三聯療法的PFS(上(shàng)圖)和(hé)OS數(shù)據(下(xià)圖)(圖片來源:參考資料[2])
FDA與澳大利亞、加拿(ná)大、新加坡和(hé)瑞士的監管機構就此次審評進行(xíng)了(le)合作(zuò)。雖然FDA今天批準了(le)Tukysa,但(dàn)該申請(qǐng)仍在其他(tā)機構的審評中。國(guó)際監管機構之間(jiān)的合作(zuò)有望允許癌症患者更早地(dì)獲得其他(tā)國(guó)家的産品。新療法的盡早上(shàng)市和(hé)成為(wèi)全球标準治療可(kě)能(néng)會對越來越國(guó)際化的癌症臨床試驗進行(xíng)産生影響,并可(kě)能(néng)加速抗癌産品的開(kāi)發。通(tōng)過同步提交和(hé)審評腫瘤藥物(wù)的框架,Orbis項目促進了(le)審評過程中不同團隊的合作(zuò),從(cóng)而幫助發現審評團隊之間(jiān)的任何監管分歧,有助于未來建立更為(wèi)一(yī)緻的審評标準。

"FDA的Orbis項目為(wèi)在FDA的國(guó)際合作(zuò)者之間(jiān)同時(shí)提交腫瘤藥物(wù)申請(qǐng)和(hé)審評提供了(le)框架。我們很(hěn)高興第一(yī)次與新加坡和(hé)瑞士的同事合作(zuò),并繼續與澳大利亞和(hé)加拿(ná)大的同事合作(zuò),為(wèi)患者提供新的治療選擇——就像今天Orbis項目下(xià)的第一(yī)個新分子實體,”FDA卓越腫瘤中心主任、FDA藥物(wù)評估和(hé)研究中心腫瘤疾病辦公室代理主任Richard Pazdur博士說。"此次批準代表了(le)HER2陽性乳腺癌患者的額外(wài)靶向治療選擇。支持該批準的臨床試驗除了(le)入組總患者群外(wài),還招募并專門研究了(le)腦轉移患者,并且證明(míng)了(le)該亞組也能(néng)獲益。”
參考資料:
[1] FDA Approves First New Drug Under International Collaboration, A Treatment Option for Patients with HER2-Positive Metastatic Breast Cancer. Retrieved April 17, 2020, from https://www.fda.gov/news-events/press-announcements/fda-approves-first-new-drug-under-international-collaboration-treatment-option-patients-her2
[2] Murthy et al., Tucatinib, Trastuzumab, and Capecitabine for HER2-Positive Metastatic Breast Cancer. The New England Journal of Medicine, DOI: 10.1056/NEJMoa1914609
注:本文旨在介紹醫(yī)藥健康研究進展,不是治療方案推薦。如(rú)需獲得治療方案指導,請(qǐng)前往正規醫(yī)院就診。
版權說明(míng):本文來自(zì)藥明(míng)康德內(nèi)容團隊,謝(xiè)轉載授權請(qǐng)在「藥明(míng)康德」微(wēi)信公衆号回複“轉載”,獲取轉載須知。