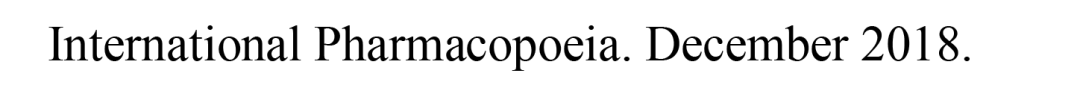1月4日,CDE發布一(yī)則“關于《化學仿制藥晶型研究技術(shù)指導原則(試行(xíng))》的通(tōng)告”(下(xià)文簡稱“指導原則”),對仿制藥晶型研究,參比制劑的選擇作(zuò)出了(le)詳細的解答(dá)。
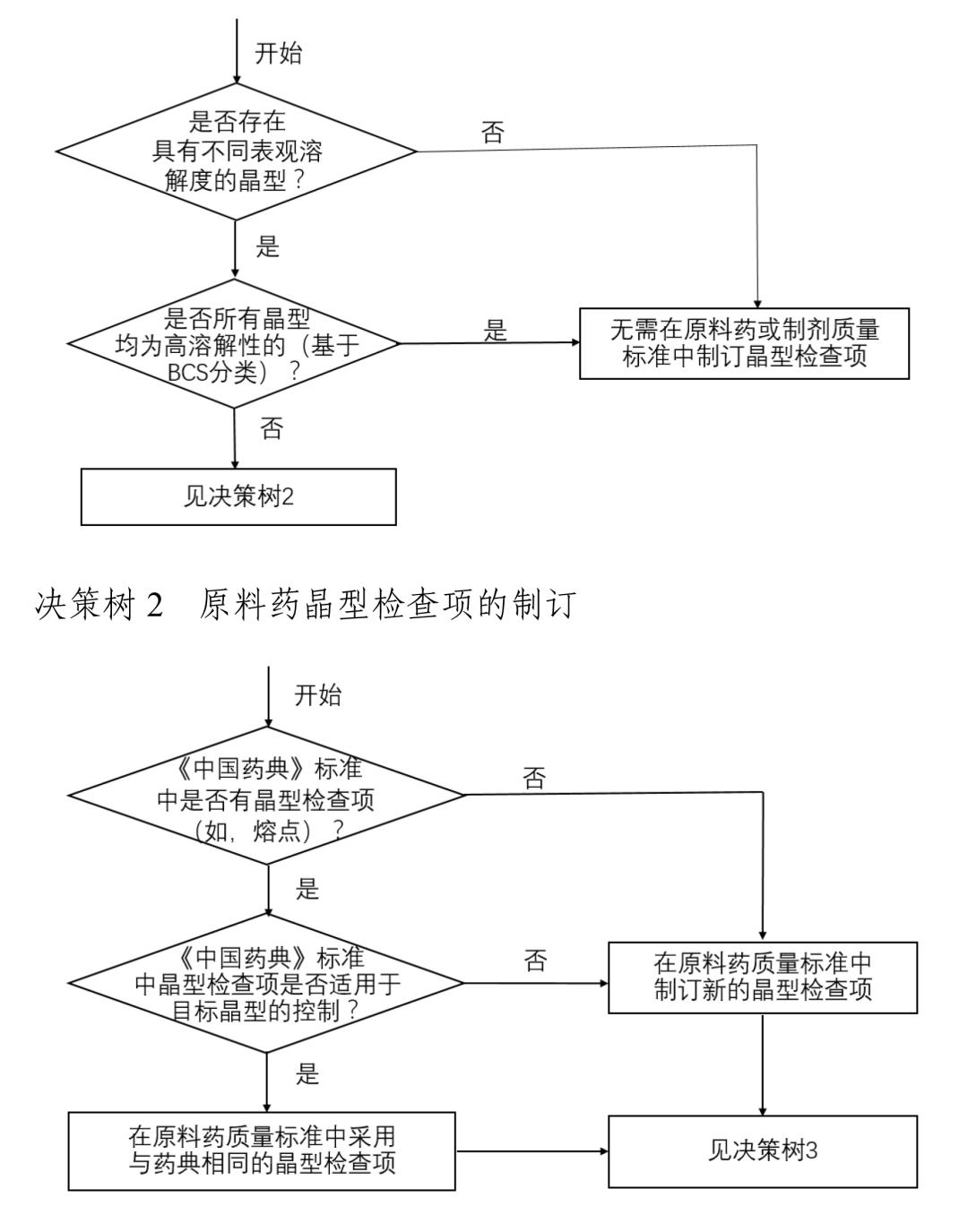
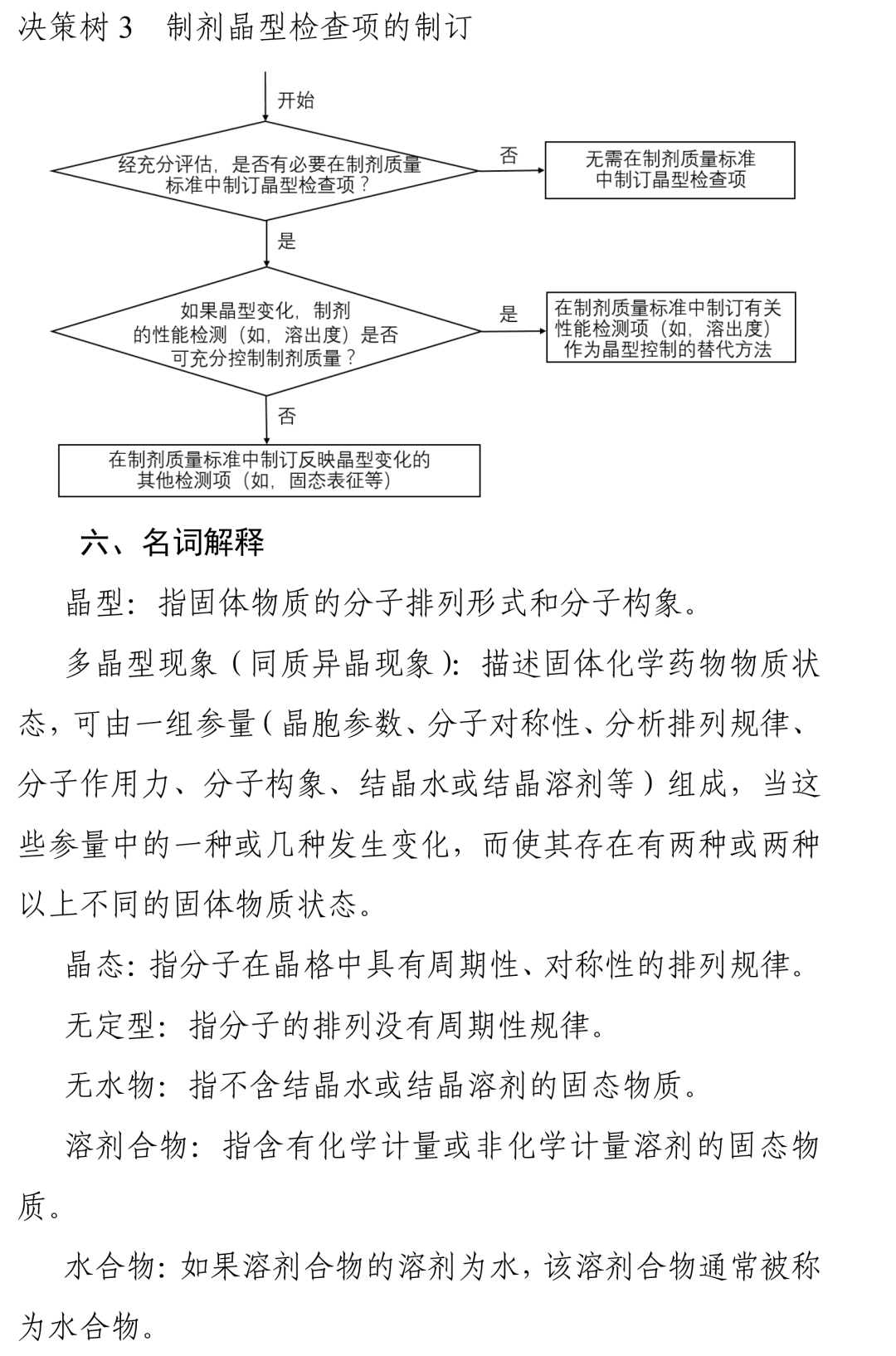
其中,指導原則在仿制藥晶型選擇中明(míng)确了(le)一(yī)個重點:對于仿制藥,通(tōng)常情況下(xià)應選擇與參比制劑一(yī)緻的晶型。若有足夠的穩定性研究數(shù)據支持且其他(tā)晶型制備的仿制藥與參比制劑生物(wù)等效,也可(kě)選擇與參比制劑不同的晶型。無論選擇何種晶型,均應對所選擇晶型進行(xíng)充分的理化性質和(hé)穩定性研究。
這(zhè)意味着,晶型的性質和(hé)穩定性是研究的關鍵。
以下(xià)是指導原則及其通(tōng)告全文:

為(wèi)規範和(hé)指導化學仿制藥的晶型研究,在國(guó)家藥品監督管理局的部署下(xià),藥審中心組織制定了(le)《化學仿制藥晶型研究技術(shù)指導原則(試行(xíng))》(見(jiàn)附件)。根據《國(guó)家藥監局綜合司關于印發藥品技術(shù)指導原則發布程序的通(tōng)知》(藥監綜藥管〔2020〕9号)要(yào)求,經國(guó)家藥品監督管理局審查同意,現予發布,自(zì)發布之日(2022年(nián)1月4日)起施行(xíng)。
特此通(tōng)告。
附件:化學仿制藥晶型研究技術(shù)指導原則(試行(xíng))
國(guó)家藥監局藥審中心
2021年(nián)12月23日