
本文由藥明(míng)康德內(nèi)容團隊編輯
3月26日,百時(shí)美施貴寶(BMS)公司宣布,美國(guó)FDA批準Zeposia(ozanimod)于治療成人(rén)複發型多發性硬化症(RMS),包括臨床孤立綜合征、複發緩解型疾病和(hé)活動性繼發性進展性疾病。Zeposia是唯一(yī)一(yī)款能(néng)為(wèi)RMS患者提供一(yī)種起始階段用藥選擇、無需進行(xíng)基因檢測、也無需患者進行(xíng)基于标簽的首次劑量觀察的鞘氨醇1-磷酸(S1P)受體調節劑,每日口服一(yī)次給藥。這(zhè)款創新療法日前被全球性專業咨詢服務公司科睿唯安(Clarivate Analytics)列為(wèi)今年(nián)可(kě)能(néng)上(shàng)市的11款潛在重磅新藥之一(yī)。

多發性硬化(MS)是一(yī)種中樞神經系統慢(màn)性炎性脫髓鞘性疾病。它的重要(yào)特征是人(rén)體中的免疫細胞攻擊保護神經的髓鞘,導緻髓鞘的損傷和(hé)脫落。而髓鞘就像保護導線的塑料套一(yī)樣,起到保護神經和(hé)絕緣的作(zuò)用,促進神經信号沿着神經的快(kuài)速傳導。髓鞘的不斷受損會導緻神經傳遞的電信号無法正常傳播。MS患者可(kě)能(néng)因此出現視(shì)力下(xià)降、複視(shì)、肢體感覺障礙、肢體運動障礙、共濟失調、膀胱或直腸功能(néng)障礙等症狀。 全球大約有250萬MS患者,而女(nǚ)性患病風(fēng)險是男(nán)性的2-3倍。在中國(guó),多發性硬化處于罕見(jiàn)病,約有超過3萬名患者深受其困。2018年(nián)5月,在中國(guó)《第一(yī)批罕見(jiàn)病目錄》中,多發性硬化被納入其中。
Zeposia是一(yī)款第二代口服選擇性鞘氨醇1-磷酸(S1P)受體調節劑。S1P在控制淋巴細胞進出淋巴結方面起到重要(yào)的作(zuò)用。在血循環和(hé)淋巴循環系統中流動的淋巴細胞會不斷進出淋巴結,而S1P是調節淋巴細胞遷移出淋巴結的信号。如(rú)果S1P受體的功能(néng)受到影響,淋巴細胞會因為(wèi)無法識别遷移出淋巴結的信号,而在淋巴結中大量駐留。這(zhè)因此會降低(dī)能(néng)夠遷移到中樞神經系統,攻擊髓鞘的炎症性淋巴細胞的數(shù)量,降低(dī)髓鞘的損傷。這(zhè)一(yī)發現也讓S1P受體成為(wèi)治療MS的熱(rè)門靶點。
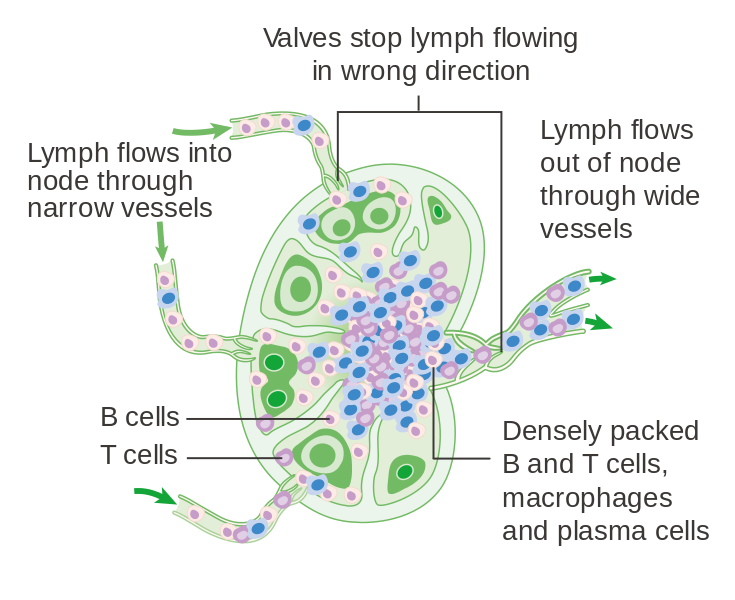
▲淋巴結結構
(圖片來源:Cancer Research UK / CC BY-SA,https://creativecommons.org/licenses/by-sa/4.0)
基于這(zhè)一(yī)原理開(kāi)發的第一(yī)代S1P受體調節劑是諾華(Novartis)公司開(kāi)發的芬戈莫德(Fingolimod,英文商品名為(wèi)Gilenya)。它在2010年(nián)獲得美國(guó)FDA批準上(shàng)市,在2018年(nián)下(xià)半年(nián),它被中國(guó)國(guó)家藥品監督管理局納入第一(yī)批《臨床急需境外(wài)新藥名單》。2019年(nián)7月12日,該藥物(wù)中國(guó)正式獲批用于治療10歲及以上(shàng)患者的複發型多發性硬化(RMS)的治療。 雖然芬戈莫德在緩解MS發作(zuò)方面表現出了(le)顯著療效,但(dàn)是它也具有較高的毒副作(zuò)用。原因是S1P受體是一(yī)個受體家族,包含從(cóng)S1P受體1(S1PR1)到S1P受體5(S1PR5)5種亞型。S1PR1是調節淋巴細胞離開(kāi)淋巴結的主要(yào)受體,而其它受體亞型具有調節內(nèi)皮細胞滲透性,以及心髒搏動頻(pín)率等作(zuò)用。芬戈莫德對S1P受體的調節功能(néng)沒有選擇性,因此它可(kě)能(néng)導緻心動過緩和(hé)黃(huáng)斑水腫等嚴重副作(zuò)用。 為(wèi)了(le)克服這(zhè)些副作(zuò)用,多家醫(yī)藥公司着手開(kāi)發第二代選擇性S1P受體調節劑。Zeposia就是這(zhè)樣一(yī)款第二代S1P受體調節劑。它能(néng)夠有選擇性地(dì)與S1PR1和(hé)S1PR5受體亞型結合,在降低(dī)血液和(hé)淋巴循環中的淋巴細胞數(shù)目,減少(shǎo)中樞神經系統的炎症反應的同時(shí),降低(dī)可(kě)能(néng)出現的副作(zuò)用。 這(zhè)款療法的半衰期為(wèi)19個小時(shí),允許每日服用一(yī)片。由于它的半衰期不長(cháng),意味着患者停藥之後,血液和(hé)淋巴循環中的淋巴細胞數(shù)目能(néng)夠迅速回升。

此次新藥批準,Zeposia治療MS患者的療效和(hé)安全性在兩項3期臨床試驗中得到了(le)驗證。其中,在名為(wèi)SUNBEAM的關鍵性3期臨床試驗裏,不同劑量的ozanimod均顯著降低(dī)了(le)患者的年(nián)複發率(ARR)。在另一(yī)項名為(wèi)RADIANCE的關鍵3期臨床試驗中,研究人(rén)員(yuán)們在為(wèi)期2年(nián)的時(shí)間(jiān)裏也觀察到了(le)較低(dī)的ARR。 目前,已有三款S1P受體調節劑獲得FDA批準,除了(le)前面提到的芬戈莫德和(hé)Zeposia以外(wài),諾華公司開(kāi)發的S1PR1/S1PR5調節劑西(xī)尼莫德(siponimod,英文商品名Mayzent也已在去年(nián)獲得FDA批準。它還去年(nián)被中國(guó)國(guó)家藥監局納入優先審評,有望早日造福中國(guó)MS患者。而楊森(Janssen)公司也在日前向FDA遞交了(le)該公司的S1PR1調節劑ponesimod的新藥申請(qǐng)(NDA)。 我們期待這(zhè)些創新療法能(néng)夠為(wèi)MS患者提供更多的治療選擇,緩解他(tā)們的疾病進展。
參考資料:
[1] U.S. Food and Drug Administration Approves Bristol Myers Squibb’s ZEPOSIA® (ozanimod), a New Oral Treatment for Relapsing Forms of Multiple Sclerosis. Retrieved March 26, 2020 from https://news.bms.com/press-release/corporatefinancial-news/us-food-and-drug-administration-approves-bristol-myers-squibbs
[2] Chaudhry et al. (2017). Sphingosine 1-Phosphate Receptor Modulators for the Treatment of Multiple Sclerosis. Neurotherapeutics,doi: 10.1007/s13311-017-0565-4
[3] This physician-scientist develops potent new medicines…fast. Retrieved March 24, 2020, from https://www.scripps.edu/support-us/your-impact/scientist-profile-hugh-rosen/index.html
[4] Multiple Sclerosis Discovery -- Episode 49 with Dr. Hugh Rosen. Retrieved March 24, 2020, from http://msdiscovery.libsyn.com/multiple-sclerosis-discovery-episode-49-with-dr-hugh-rosen
[5] 降血糖、降血脂、抗癌... 盤點今年(nián)有望上(shàng)市的11款潛在重磅藥, Retrieved March 24, 2020, from https://mp.weixin.qq.com/s?__biz=MzAwMDA5NTIxNQ==&mid=2649991491&idx=1&sn=8f85ad71894907a2976edbb36aa8e7b7