
本文由傲骨原創,在“ 佰傲谷BioValley”公衆号上(shàng)發表
近日(3月26日),百時(shí)美施貴寶(BMS)宣布FDA批準了(le)ZEPOSIA®(ozanimod)0.92mg用于治療成人(rén)複發型多發性硬化症(RMS),包括臨床孤立綜合征(CIS),複發緩解型多發性硬化(RRMS)和(hé)繼發進展多發性硬化(SPMS)。
ZEPOSIA
ZEPOSIA是一(yī)種一(yī)日一(yī)次的口服藥物(wù),是目前唯一(yī)一(yī)款不需要(yào)患者進行(xíng)基因檢測,也不需要(yào)首次用藥後按照說明(míng)進行(xíng)健康監測的S1PR受體調節劑。
ZEPOSIA(Ozanimod)是一(yī)款S1PR受體調節劑,對淋巴細胞表面的S1PR1和(hé)S1PR5均有較高的親和(hé)力。
具體而言,當Ozanimod與受體結合後就可(kě)以阻止淋巴細胞離開(kāi)淋巴結進入中樞神經系統,發揮抗炎作(zuò)用。此外(wài),Ozanimod也能(néng)進入中樞神經系統,直接與少(shǎo)突膠質細胞和(hé)星形膠質細胞上(shàng)的S1PR結合,促進髓鞘再生和(hé)防止炎症。
此次批準主要(yào)基于一(yī)項迄今為(wèi)止最大規模的關鍵頭對頭RMS研究——随機,陽性對照III期 SUNBEAM(與幹擾素β-1a相比,ZEPOSIA治療複發性多發性硬化的安全性和(hé)有效性)和(hé)RADIANCE Part B(選擇性S1P受體調節劑ZEPOSIA治療複發性多發性硬化的安全性和(hé)有效性),共有超過2600名患者參加了(le)上(shàng)述研究。
SUNBEAMSUNBEAM是一(yī)項多中心,随機,雙盲,雙模拟,陽性對照關鍵III期臨床研究,旨在評估口服ZEPOSIA(0.92mg,相當于1mg)相比兩年(nián)期治療,每周肌注AVONEX® (interferon beta-1a)的有效性,安全性和(hé)耐受性。試驗共有來自(zì)21個國(guó)家150處地(dì)點的1320位RMS患者參加。
研究的主要(yào)重點是治療期間(jiān)的年(nián)度複發率(ARR)。次要(yào)終點則包括1年(nián)內(nèi)高信号T2加權腦部MRI損傷的增加和(hé)增大和(hé)钆增強腦部MRI損傷的增多和(hé)增大。
最終研究将根據SUNBEAM和(hé)RANDIANCE Part B III期臨床試驗數(shù)據,對3月時(shí)的确認殘疾進展進行(xíng)預先指定的分析。
RADIANCE
RADIANCE Part B是一(yī)項多中心,随機,雙盲,雙模拟,陽性對照關鍵III期臨床研究,旨在評估口服ZEPOSIA(0.92mg,相當于1mg)相比兩年(nián)期治療,每周肌注AVONEX® (interferon beta-1a)的有效性,安全性和(hé)耐受性。試驗共有來自(zì)21個國(guó)家150處地(dì)點的1320位RMS患者參加。研究的主要(yào)重點是2年(nián)期的度複發率(ARR)。次要(yào)終點則包括2年(nián)內(nèi)高信号T2加權腦部MRI損傷的增加和(hé)增大和(hé)钆增強腦部MRI損傷的增多和(hé)增大。
最終研究将根據SUNBEAM和(hé)RANDIANCE Part B III期臨床試驗數(shù)據,對3月時(shí)的确認殘疾進展進行(xíng)預先指定的分析。
兩項研究中,相比AVONEX®(幹擾素β-1a),ZEPOSIA在降低(dī)年(nián)複發率(ARR)和(hé)腦損傷數(shù)量及大小方面都(dōu)有着更好的表現,具體而言:
與AVONEX相比,ZEPOSIA第一(yī)年(nián)ARR降低(dī)了(le)48%,第二年(nián)ARR降低(dī)38%(絕對ARR分别為(wèi)0.18 vs 0.35,0.17 vs 0.28)。
第一(yī)年(nián)時(shí),與AVONEX相比,使用ZEPOSIA治療減少(shǎo)了(le)63%的T1加權钆增強(GdE)腦部損傷(0.16 vs 0.43)和(hé)48%新發或增大的T2腦部損傷(1.47 vs 2.84)。
第二年(nián)時(shí),與AVONEX相比,使用ZEPOSIA治療減少(shǎo)了(le)53%的T1加權钆增強(GdE)腦部損傷(0.18 vs 0.37)和(hé)42%新發或增大的T2腦部損傷(1.84 vs 3.18)
安全性方面,兩組患者在3月和(hé)6月确認殘疾進展時(shí)沒有顯示出統計學上(shàng)的顯著差異。
MS藥物(wù)市場
多發性硬化症(Multiple Sclerosis, MS)是一(yī)種嚴重、終身、進行(xíng)性、緻殘性的中樞神經系統脫髓鞘疾病,疾病列入第一(yī)批罕見(jiàn)病藥物(wù)目錄。可(kě)以分為(wèi)複發緩解型(RRMS,85%)、原發進展型(PPMS 10%)和(hé)進展複發性(PRMS, 罕見(jiàn)型5%)。其中80% RRMS可(kě)進展為(wèi)繼發進展型多發性硬化症(SPMS)。
雖然多發性硬化症(MS)雖然屬于罕見(jiàn)病,但(dàn)卻坐(zuò)擁超過200億美元的龐大市場。
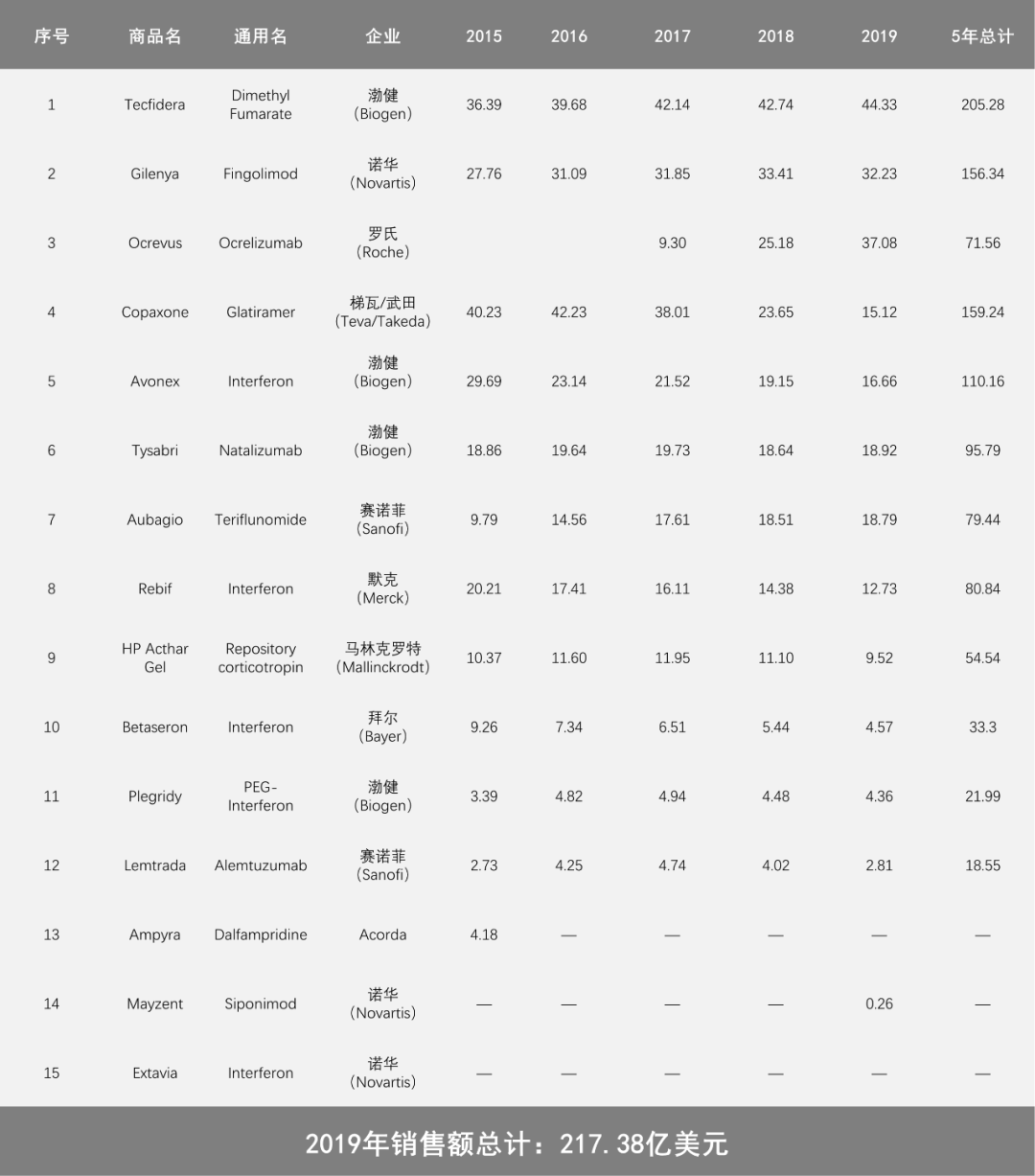
此次BMS獲批上(shàng)市的ZEPOSIA屬于S1PR受體調節劑,預計将與其餘兩款已獲批上(shàng)市的S1P受體調節劑産生直接競争。ZEPOSIA來自(zì)于BMS與新基的并購,曾經經曆過上(shàng)市審批被拒。
2010年(nián)9月,諾華旗下(xià)S1PR調節劑Gilenya(fingolimod)獲批一(yī)線治療MS,作(zuò)為(wèi)一(yī)款First-in-class的MS治療藥物(wù),極大的減少(shǎo)和(hé)緩解了(le)MS的複發和(hé)殘疾進展。2018年(nián)8月,藥物(wù)适用人(rén)群獲批擴大到兒童。上(shàng)市10年(nián)來,Gilenya早已進入40億美元年(nián)銷售額的超重磅水平,并依然保持着增長(cháng)勢頭。
2019年(nián)3月,諾華宣布第二款S1PR調節劑——Mayzent(siponimod),獲得FDA批準用于複發型多發性硬化症(MS)成人(rén)患者的治療,包括SPMS,RRMS和(hé)CIS。截至2019年(nián)底,Mayzent共取得2600萬美元銷售額。
Gilenya定價為(wèi)60000美元/年(nián),Mayzent定價為(wèi)88000美元/年(nián)。
值得注意的是,2019年(nián)12月5日,FDA同日批準3款fingolimod首仿藥,分别來自(zì)東陽光(guāng)、Biocon和(hé)太陽藥業。
近年(nián)來,MS領域進展顯著。幹擾素類産品,例如(rú)本次試驗中的陽性對照藥物(wù)AVONEX銷售額持續大幅下(xià)滑,被依從(cóng)性和(hé)療效更好的口服類藥物(wù)以及單抗類藥物(wù)所取代。
國(guó)內(nèi)MS治療現狀
根據中華醫(yī)學會神經病學分會發布的《多發性硬化患者生存報告(2018)》,我國(guó)已确診MS患者群體大約有2-3萬人(rén)。
在我國(guó)多發性硬化症患者治療并不理想,主要(yào)體現在治療藥物(wù)可(kě)及性差,治療率低(dī),治療負擔重等方面。
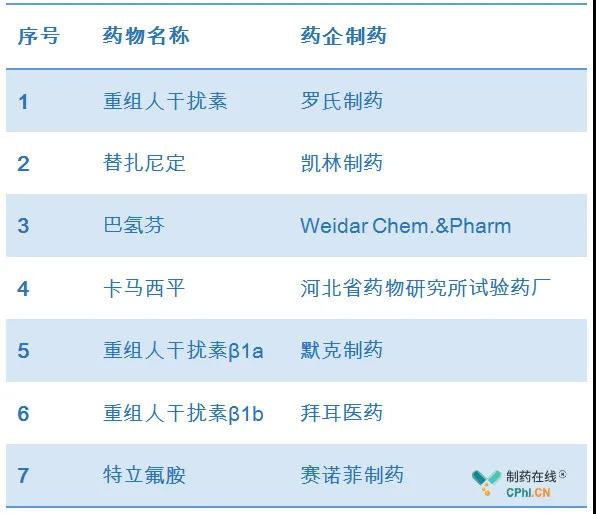
2019年(nián)6月,諾華Gilenya(商品名捷靈亞®)在我國(guó)獲批上(shàng)市。除此之外(wài),諾華另一(yī)款S1PR調節劑Mayzent也于2019年(nián)2月遞交了(le)上(shàng)市申請(qǐng),我國(guó)MS患者迎來了(le)更多的療法選擇。此外(wài),根據制藥在線CPhi統計,我國(guó)市場上(shàng)還有來自(zì)羅氏,拜爾,默克的幹擾素類産品和(hé)來自(zì)賽諾菲的奧巴捷(Aubagio特立氟胺)等。
參考來源:
1. 渤健,諾華,羅氏,賽諾菲,默克,武田馬琳克羅特2019年(nián)财報
2. 東陽光(guāng)芬戈莫德首仿藥獲F, 佰傲谷/Eastwood
3. 《多發性硬化患者生存報告(2018)》
4. 制藥在線CPhi.CN微(wēi)信公衆号