
本文由作(zuò)者:識林-藍(lán)杉原創
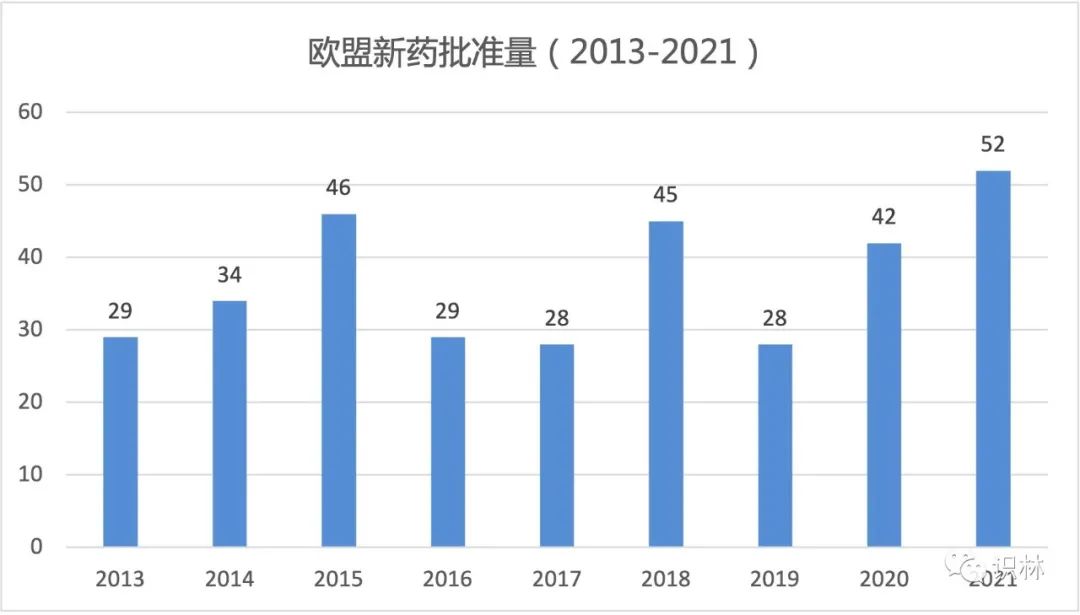
2021 年(nián)歐盟批準了(le)創紀錄的 52 個含有新活性成分(NAS)的藥物(wù),其中包括批準了(le)用于新冠疾病的 4 個新疫苗和(hé) 3 個新藥。
與 2020 年(nián)(42 個含 NAS 的産品)相比,該數(shù)字增加了(le)近四分之一(yī),比 2019 年(nián)(28 個)增加了(le)近一(yī)半。過去十年(nián)中,創下(xià)批準最多記錄的一(yī)年(nián)是 2015 年(nián),有 46 個含 NAS 新藥獲得上(shàng)市許可(kě)(MA)。
雖然新冠疫情加劇了(le)歐洲藥品管理局(EMA)已經迅速增加的工(gōng)作(zuò)量和(hé)資源問(wèn)題,但(dàn) EMA 受益于引入的一(yī)些監管靈活性,以允許更快(kuài)速地(dì)開(kāi)發、評價和(hé)批準新冠疫苗和(hé)藥物(wù),其中包括滾動審評、更快(kuài)批準流程以及有條件上(shàng)市許可(kě)的使用。
孤兒藥與&腫瘤藥
與 2020 年(nián)一(yī)樣,2021 年(nián)批準了(le) 17 個罕見(jiàn)病藥物(wù)。其中包括 Deciphera Pharmaceuticals 公司用于治療晚期胃腸道(dào)間(jiān)質瘤的 Qinlock (ripretinib),Incyte
Corporation/MorphoSys AG 公司用于治療彌漫性大 B 細胞淋巴瘤的 Minjuvi (tafasitamab),以及羅氏用于 5q 脊髓性肌萎縮症兒科患者的 Evrysdi (risdiplam)。
另外(wài)批準了(le) 17 個用于腫瘤适應症的新藥,其中一(yī)個是新基/百時(shí)美施貴寶公司用于成人(rén)複發和(hé)難治性多發性骨髓瘤患者的基因療法 Abecma (idecabtagene vicleucel)。
另一(yī)獲批上(shàng)市的基因療法是 bluebird bio 公司用于早期腦型 X 連鎖腎上(shàng)腺腦白質營養不良症的 Skysona (elivaldogene autotemcel)。
值得注意的是,去年(nián)批準的産品之一(yī)包含兩種新活性成分:羅氏/再生元的新冠治療藥 Ronapreve (casirivimab +
imdevimab) 。而另外(wài)兩個新藥,口服避孕藥 Gedeon Richter 公司的 Drovelis 和(hé) Estetra 公司的 Lydisilka 含有相同的 NAS — 雌四醇(與屈螺酮組合)。
阿斯利康的 Lumoxiti 批準被撤回
17 個腫瘤藥批準之一(yī)是阿斯利康公司用于成人(rén)複發或難治性毛細胞白血病患者的 Lumoxiti (moxetumomab pasudotox),該産品是在特殊條件下(xià)獲得批準的孤兒藥。上(shàng)市許可(kě)在獲批 5 個月後因商業原因應申報人(rén)要(yào)求撤回。
有條件上(shàng)市許可(kě)
2021 年(nián),14 個新産品在歐盟獲得有條件上(shàng)市許可(kě)(CMA)。在 CMA 下(xià)獲得許可(kě)的申辦人(rén)同意提供更多産品數(shù)據,以期最終轉為(wèi)完整的上(shàng)市許可(kě)。
新冠産品
去年(nián)的 CMA 包括四個新冠疫苗:Moderna 公司的 Spikevax,AstraZeneca/牛津大學的 Vaxzevria,強生新冠疫苗,以及 Novavax 的 Nuvaxovid。歐盟首個新冠疫苗輝瑞/BioNTech 的 Comirnaty 已于 2020 年(nián) 12 月獲得批準。
2021 年(nián),歐盟還根據标準上(shàng)市許可(kě)程序批準了(le) 3 個含有 NAS 的新冠治療藥:羅氏/再生元的 Ronapreve,Celltrion 的 Regkirona
(regdanvimab)以及葛蘭素史克/Vir 公司的 Xevudy (sotrovimab)。
另外(wài),還有兩個現有用于炎症性疾病的藥物(wù)
— 瑞典 Orphan Biovitrum AB 公司的 Kineret
(anakinra)和(hé)羅氏/Chugai 公司的 Actemra/RoActemra (tociluzumab),将歐盟适應症擴展到包括治療嚴重新冠疾病患者。
特例批準
4 個新藥受益于另一(yī)歐盟監管機制:特例批準 , 這(zhè) 4 個藥分别是:Stemline Therapeutics 公司用于母細胞性漿細胞樣樹(shù)突狀細胞腫瘤的 Elzonris (tagraxofusp),再生元用于純合子家族性高膽固醇血症的 Evkeeza (evinacumab),Albireo Pharma 公司用于治療進行(xíng)性家族性肝內(nèi)膽汁淤積症的 Bylvay (odevixibat) , 以及批準後撤回的 Lumoxiti。
特例批準用于因為(wèi)所讨論的疾病很(hěn)少(shǎo)遇到或者收集信息是不道(dào)德的,從(cóng)而在正常使用條件下(xià)不能(néng)期望申辦人(rén)提供關于其産品的全面安全性和(hé)有效性數(shù)據的情況。
加速審批
兩個孤兒藥 Bylvay 和(hé) Evrysdi 于 2021 年(nián)在加速程序下(xià)獲得批準。歐盟加速審批用于對公共衛生具有重大意義的藥物(wù) , 審評時(shí)間(jiān)為(wèi) 150 天,而不是标準的 210 天。